- Hydroxybenzol
-
Strukturformel 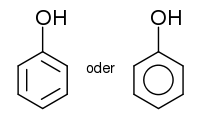
Allgemeines Name Phenol Andere Namen - Carbol
- Hydroxybenzen
- Hydroxy-Cyclohexatrien
- Hydroxybenzol
- Karbolsäure (veraltet)
- Steinkohlenteerkreosot
- Benzolol
- Benzenol
Summenformel C6H6O CAS-Nummer 108-95-2 PubChem 996 ATC-Code Kurzbeschreibung weiße Kristalle, durch Oxidation auch gelblich bis rosa Eigenschaften Molare Masse 94,11 g·mol−1 Aggregatzustand fest
Dichte 1,071 g·cm−3 [1]
Schmelzpunkt 41 °C [1]
Siedepunkt 182 °C [1]
Dampfdruck 0,2 hPa (20 °C)
pKs-Wert 9,99 [2]
Löslichkeit gut in Wasser (84 g·l−1 bei 20 °C)
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Ätzend (T) (C) R- und S-Sätze R: 23/24/25-34-48/20/21/22-68 S: (1/2)-24/25-26-28-36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 7,8 mg·m−3 [1]
LD50 317 mg·kg−1 (oral Ratte)[4]
WGK 2 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Das Phenol ist der einfachste Vertreter der Phenole. Phenole sind organische Verbindungen, in denen mindestens eine Hydroxygruppe direkt an einem aromatischen Ring gebunden ist. Phenol ist ein Derivat des Benzols.
Inhaltsverzeichnis
Darstellung
Im industriellen Maßstab wird die Grundchemikalie Phenol durch das Cumolhydroperoxid-Verfahren, auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt, hergestellt:
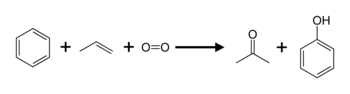
Benzol und Propen werden zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt. Cumol wird durch Luftsauerstoff zum Hydroperoxid oxidiert, welches durch saure Aufarbeitung unter Umlagerung zu Phenol und Aceton zerfällt[5]. Das gleichzeitige Entstehen zweier leicht trennbarer, wertvoller Produkte macht dieses Verfahren besonders wirtschaftlich. Im Labormaßstab werden Phenole auch durch Verkochen von Diazoniumsalzen, welche durch die Diazotierung von Anilin mit Salpetriger Säure in der Kälte entstehen, hergestellt.
Eine weitere Darstellungsmöglichkeit besteht im Zusammenschmelzen des Natriumsalzes der Benzolsulfonsäure mit Alkalihydroxid:
Eigenschaften
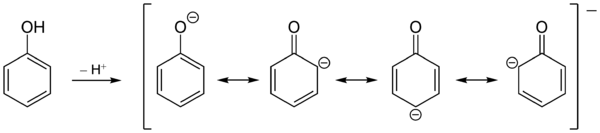
Phenol ist hydroxysubstituiertes Benzol. Sein Schmelzpunkt liegt bei 41 °C und der Siedepunkt bei 182 °C. Reines Phenol bildet bei Zimmertemperatur farblose Kristallnadeln, jedoch ist das kommerziell erhältliche Produkt i. d. R. durch geringe, aber intensiv gefärbte Verunreinigungen rosa bis rötlich-braun gefärbt. Es besitzt einen charakteristischen, aromatischen Geruch. Die Hydroxy-Gruppe ist für einen Alkohol relativ sauer und Phenol eine schwache Säure. Die Ursache ist die Mesomeriestabilisierung der korrespondierenden Base, des Phenolations. Die negative Ladung kann in den Ring delokalisiert werden.
Im Gegensatz zu aliphatischen Alkoholen gehen Phenole nur bei hohen Temperaturen und Anwesenheit spezieller Katalysatoren nucleophile Substitutionsreaktionen unter Ersatz der Hydroxy-Gruppe durch andere Nucleophile ein.[6] Die Hydroxy-Funktion zeigt, besonders im deprotonierten Zustand, eine ausgeprägten +M-Effekt. Daneben zeigt sie einen −I-Effekt. Da dieser aber deutlich kleiner ist als der +M-Effekt, wird Phenol sehr leicht elektrophil angegriffen. Der Angriff erfolgt bevorzugt in ortho- und para-Position zur Hydroxy-Gruppe. Wegen des elektronenschiebenden Charakters der Hydroxy-Gruppe ist Phenol etwa tausendmal reaktiver als Benzol.
Die Bevorzugung des ortho- bzw. para-Angriffs von Elektrophilen lässt sich durch Betrachtung die Grenzstrukturen des Phenolat-Anions verstehen. Die negative Ladung wird in den aromatischen Ring auf die ortho- und para-Positionen delokalisiert. Da Elektrophile bevorzugt elektronenreiche Positionen angreifen, kommt es zu der beobachteten Regioselektivität. Die Substitution in para-Position ist zusätzlich bevorzugt, da es dort nicht zu sterischen Wechselwirkungen des angreifenden Elektrophils mit den freien Elektronenpaaren des Sauerstoffs kommt.
Die Keto-Enol-Tautomerie liegt wegen der Ausbildung des thermodynamisch günstigen aromatischen Systems vollständig auf der Enol-Seite. Cyclohexadienon kommt folglich nicht vor.
Eine technisch bedeutende nucleophile Substitutionsreaktion ist die Darstellung von Anilin aus Phenol bei 250 °C und Anwesenheit eines Oxid-Katalysators (Aluminium-, Silicium- oder Magnesiumoxid, auch Borsäure) als „Halcon-Prozess“.[7]
Verwendung
Sir Joseph Lister setzte es 1865 zuerst als Antiseptikum bei der Wunddesinfektion ein; wegen seiner hautirritierenden Nebenwirkung wurde es aber in der Chirurgie bald durch andere Antiseptika ersetzt. Phenol verursacht Verätzungen und ist ein Nerven-/Zellgift. Wegen seiner bakteriziden Wirkung wird es noch heute - wenngleich seltener - als Desinfektionsmittel eingesetzt. Es wird auch als Ausgangsstoff zur Herstellung von Medikamenten, u.a. von Acetylsalicylsäure, verwendet, als Unkrautvernichtungsmittel und zur Synthese von Kunstharzen. Eines der ersten synthetisch hergestellten Kunstharzprodukte ist Bakelit, ein Polykondensat aus Phenol und Formaldehyd.
Während des Zweiten Weltkriegs töteten KZ-Ärzte Häftlinge unter anderem auch durch intrakardiale Phenolinjektionen.
In der Mikroskopie dient es zur Herstellung von Phenolwasser, bestehend aus zehn Anteilen Phenol und einem Anteil Wasser.
In der Molekularbiologie war die Extraktion organischen Gewebes mit Mischungen aus Phenol, Chloroform und Isoamylalkohol eines der ersten Verfahren, um hochreine DNA zu gewinnen.
Phenol-Resorcin-Formaldehyd-Kleber werden im konstruktiven Holzbau verwendet.
Historische Beschreibung
„Es handelt sich um eine Substanz, die für die Farbenindustrie und Medizin (als Desinfektionsmittel) eine außerordentliche Bedeutung erlangt hat. Der Handelsname ist immer noch Karbolsäure, während der wissenschaftliche Name jetzt Phenol ist; diese Substanz besitzt zwar die Eigenschaften einer schwachen Säure und ist imstande, sich mit Basen zu verbinden, wird deshalb auch Phenylsäure oder Phensäure genannt, zugleich aber und in noch höherem Grade spielt sie die Rolle eines einatomigen Alkohols, daher auch der Name Phenylalkohol, den man in Phenol gekürzt hat. Man gewinnt die Karbolsäure hauptsächlich aus dem Steinkohlenteer und dem Braunkohlenteer, im Holzteer sind nur äußerst geringe Mengen davon enthalten, denn das Kreosot des Holzteers besteht nicht, wie man eine Zeit lang glaubte, aus Phenol, sondern aus dem strukturell ähnlichen Kresol, sowie noch einigen anderen Stoffen. Um die Karbolsäure zu gewinnen, behandelt man den zwischen 150–200 °C übergehenden Teil des Teers mit Natronlauge, welche sich mit der Karbolsäure und dem Kresol, das auch im Steinkohlenteer enthalten ist, verbindet, trennt diese Lösung von den übrigen Teerbestandteilen und zersetzt sie mit einer Säure. Man destilliert dann das abgeschiedene ölige Produkt und fängt das, was über 190 °C übergeht, besonders auf; letzteres wird als rohes Kresol, das, was unter 190 °C übergeht, als rohe Karbolsäure verkauft. Beide Substanzen sind in diesem Zustande noch braune, sehr übel riechende, ölige Flüssigkeiten. Diese rohe Karbolsäure (acidum carbolicum crudum) wird teils weiter gereinigt, teils wird sie zur Konservierung von Holz und zum Desinfizieren von Abtrittgruben verwendet.“
– aus: Merck's Warenlexikon, Verlag von G. A. Gloeckner, Leipzig, Dritte Auflage, 1884, S. 250–251
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 108-95-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 28. März 2008 (JavaScript erforderlich).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Eintrag zu CAS-Nr. 108-95-2 im European chemical Substances Information System ESIS
- ↑ NOAA Material Safety Data Sheet.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006
- ↑ S. A. Lawrence: Amines: synthesis, properties and applications. S. 80, Cambridge University Press, 2004, ISBN 9780521782845
- ↑ H.-J. Arpe, K. Weissermel: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. 6. Auflage, S. 418, Wiley-VCH, 2007, ISBN 9783527315406
Weblinks
Wikimedia Foundation.

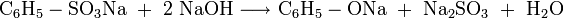
![\mathrm{C_6H_5OH \ + \ NH_3 \ \xrightarrow[Kat.]{250^{\circ}C} \ C_6H_5NH_2 \ + \ H_2O}](/pictures/dewiki/56/87e081eea6830d96fd849d4e54b41fd6.png)