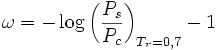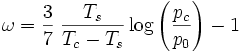- Azentric-Faktor
-
Der azentrische Faktor nach Pitzer[1], auch Azentrizitätsfaktor genannt und mit ω bezeichnet, ist eine dimensionslose Stoffgröße. Er dient in der Thermodynamik als Maß für die Abweichung eines Moleküls von der idealen Kugelform und findet hauptsächlich Anwendung in thermischen Zustandsgleichungen für reale Gase.
Der azentrische Faktor ist definiert als:
- Tr=T/Tc - reduzierte Temperatur
- Ps - Sättigungsdampfdruck bei Tr=0,7
- Pc - kritischer Druck
Damit ist
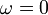 , wenn
, wenn 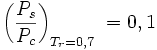 ist,
ist,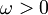 , wenn
, wenn 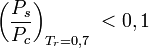 ist,
ist,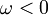 , wenn
, wenn 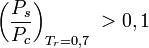 ist.
ist.
Sind für einen Stoff die kritische Temperatur Tc, der kritische Druck pc und die Siedetemperatur Ts bei Normaldruck p0 = 1,01325bar bekannt, dann kann der azentrische Faktor berechnet werden nach:
Bei den Temperaturen handelt es sich selbstverständlich um absolute Temperaturen.
Für Stoffe, deren Moleküle nur wenig von der Kugelform abweichen(z.B. Methan), gilt
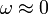 .
.Der Azentrizitätsfaktor wurde ursprünglich von Pitzer als ein Ausdruck in der Gleichung für den Kompressibilitätsfaktor verwendet. Durch die Anpassung an die experimentell ermittelten Dampfdrücke von Kohlenwasserstoffen, ist die Gleichung bei diesen recht exakt.
Beispiele
-
Stoff Tc Pc ω Helium-3 (He3) 3,3 K 1,1 bar -0,473 Helium (He) 5,2 K 2,3 bar -0,365 Argon (Ar) 150,8 K 48,7 bar 0,0001 Xenon (Xe) 289,7 K 58,4 bar 0,008 Wasserstoff (H2) 33,0 K 12,9 bar -0,216 Stickstoff (N2) 126,2 K 33,9 bar 0,039 Sauerstoff (O2) 154,6 K 50,4 bar 0,025 Fluor (F2) 144,3 K 52,2 bar 0,054 Chlor (Cl2) 416,9 K 79,8 bar 0,090 Brom (Br2) 588,0 K 103,0 bar 0,108 Fluorwasserstoff (HF) 461,0 K 64,8 bar 0,329 Wasser (H2O) 647,3 K 221,2 bar 0,344 Schweres Wasser (D2O) 644,0 K 216,6 bar 0,351 Ammoniak (NH3) 405,5 K 113,5 bar 0,250 Methan (CH4) 190,4 K 46,0 bar 0,011 Ethylen (C2H4) 282,4 K 50,4 bar 0,089 Propan (C3H8) 369,8 K 42,5 bar 0,153 n-Butan (C4H10) 425,2 K 38,0 bar 0,199 Isobutan (C4H10) 408,2 K 36,5 bar 0,183 Kohlenmonoxid (CO) 132,9 K 35,0 bar 0,066 Kohlendioxid (CO2) 304,1 K 73,8 bar 0,239 Tetrafluormethan (CF4) 227,6 K 37,4 bar 0,177 Tetrachlorkohlenstoff (CCl4) 556,4 K 45,6 bar 0,193 Benzol (C6H6) 562,2 K 48,9 bar 0,212 Toluol (C7H8) 591,8 K 41,0 bar 0,263 Methanol (CH4O) 512,6 K 80,9 bar 0,556 Ethanol (C2H6O) 513,9 K 61,4 bar 0,644 Aceton (C3H6O) 508,1 K 47,0 bar 0,304 Essigsäure (C2H4O2) 592,7 K 57,9 bar 0,447 Schwefeldioxid (SO2) 430,8 K 78,8 bar 0,256 Schwefeltrioxid (SO3) 491,0 K 82,1 bar 0,481 Quecksilber (Hg) 1765,0 K 1510 bar -0,167
Literatur
- ↑ Pitzer K.S., „Corresponding States for Perfect Liquids“, J.Chem.Phys., 7, 583-590, 1939
Weblinks
Wikimedia Foundation.