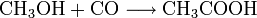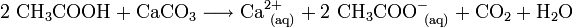- Azetat
-
Strukturformel 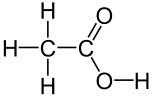
Allgemeines Name Essigsäure Andere Namen - Acetoxylsäure
- Acetylsäure (veraltet)
- acidum aceticum (lateinisch)
- Äthansäure
- Eisessig (Bez. für konzentrierte Säure)
- Ethansäure
- Ethoxylsäure
- Holzsäure (veraltet, ungebräuchlich)
- Methancarbonsäure
- Methylcarbonsäure
- E 260
Summenformel C2H4O2 CAS-Nummer 64-19-7 PubChem 176 ATC-Code Kurzbeschreibung stechend riechende Flüssigkeit mit typischem Geruch [1] Eigenschaften Molare Masse 60,05 g·mol−1 Aggregatzustand flüssig
Dichte 1,05 g·cm−3 [1]
Schmelzpunkt Siedepunkt 118 °C [1]
Dampfdruck pKs-Wert 4,76 [2]
Löslichkeit vollständig mischbar mit Wasser (20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) R- und S-Sätze R: 10-35 S: (1/2)-23-26-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 10 ml·m−3; 25 mg·m−3 [1]
LD50 3310 mg·kg−1 (Ratte, oral) [4]
Thermodynamische Eigenschaften ΔHf0 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Essigsäure, nach IUPAC-Regelung Ethansäure, ist eine farblose, flüssige, ätzende und typisch riechende Carbonsäure. Als Lebensmittelzusatzstoff hat sie die Bezeichnung E 260. Wässrige Lösungen der Essigsäure werden trivial nur Essig und konzentrierte Essigsäure Eisessig genannt. Der lateinische Name für Essigsäure ist Acidum aceticum. Die Salze der Essigsäure heißen Acetate, ihre Ester nennt man ebenfalls Acetate oder Ethanoate. In der Biochemie wird der Ausdruck Acetat dem der Essigsäure vorgezogen, da Essigsäure unter physiologischen Bedingungen größtenteils deprotoniert als Acetat-Anion (CH3COO−) vorliegt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Klassische biologische Herstellung
Die klassische Herstellung von Essigsäure ist die Veratmung von Ethanol (Alkohol) durch Acetobacter oder Gluconobacter-Bakterien. Diese wandeln durch Gärungsprozesse entstandenes Ethanol durch Oxidation in Essigsäure um. Es handelt sich biochemisch betrachtet um eine unvollständige Atmung (nicht wie es irrtümlich oft beschrieben wird, um eine Gärungsform). Ausgangsprodukte können z. B. Wein, Bier oder Malz sein. Haushaltsessig besteht aus biogenem Essig oder verdünntem synthetischen Essig und enthält 5 % Essigsäure. Essigessenz ist eine 25%ige synthetische Essigsäurelösung in Wasser, riecht stark stechend und darf nur verdünnt in Speisen verwendet werden.
Großtechnische chemische Herstellung
Die bedeutendste industrielle Synthese für Essigsäure ist die katalytische Umsetzung von Methanol mit Kohlenmonoxid unter Druck (Monsanto-Prozess).
Daneben kann Essigsäure auch synthetisch durch Oxidation von Acetaldehyd mit Luft oder Sauerstoff unter Verwendung von Mn(OAc)2 als Katalysator oder durch partielle Oxidation anderer Kohlenwasserstoffe hergestellt werden.
Technisch werden auch noch die Luftoxidation von n-Butan bei etwa 180 °C und 85 bar, die katalytische Oxidation von Leichtbenzin sowie die Rektifikation von Holzessig genutzt[5].
Eigenschaften
Physikalische Eigenschaften
Essigsäure besitzt mit 118 °C eine relativ hohe Siedetemperatur gegenüber polaren Stoffen mit vergleichbarer molarer Masse (beispielsweise 1-Propanol: Siedepunkt 97 °C). Die Ursache dafür ist die Fähigkeit der Essigsäure-Moleküle, über ihre Carboxylgruppen zwei „gegenseitige“ Wasserstoffbrückenbindungen auszubilden, so dass Dimere aus zwei Essigsäure-Molekülen entstehen, die sich wie ein Molekül doppelter molarer Masse verhalten. Daher wird für die Überleitung dieser Dimere in die Gasphase ein höherer Energiebetrag erforderlich, erkennbar an der „erhöhten“ Siedetemperatur.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,68206, B = 1642,540 und C = −39,764 im Temperaturbereich von 290,26 bis 391,01 K.[6]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−484,5 kJ·mol−1
−433 kJ·mol−1 [7]Standardentropie S0l, 1 bar
S0g158,0 J·mol−1·K−1[8]
282,84 J·mol−1·K−1[9]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −875,16 kJ·mol−1[10] Wärmekapazität cp 123,1 J·mol−1·K−1 (25 °C)[8]
63,44 J·mol−1·K−1 (25 °C)[7]als Flüssigkeit
als GasSchmelzenthalpie ΔfH0 11,72 kJ·mol−1 [8] beim Schmelzpunkt Schmelzentropie ΔfS0 40,5 kJ·mol−1 [8] beim Schmelzpunkt Verdampfungsenthalpie ΔVH0 23,7 kJ·mol−1 [11] beim Normaldrucksiedepunkt Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 22,84 kJ/mol, α = 0,0184, β = −0,0454 und Tc = 592,7 K im Temperaturbereich zwischen 298 und 392 K beschreiben. [11]
Chemische Eigenschaften
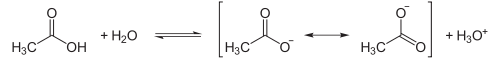
Essigsäure steht in wässriger Lösung mit Acetat im Gleichgewicht (dissoziiert), wobei die negative Ladung des Acetates mesomeriestabilisiert ist.
Diese Delokalisation der entstehenden negativen Ladung macht den Ablauf der Dissoziation (genauer Protolyse) überhaupt erst in nennenswertem Umfang möglich, was aber für alle Carbonsäuren gilt. Das dabei entstehende Hydroniumion macht ihren Säurecharakter aus. Dieses Gleichgewicht liegt in Essigsäurelösung nennenswerter Konzentration (z. B. 1 mol/l) allerdings stark auf Seiten der undissoziierten Säure, weshalb sie den schwachen Säuren zuzurechnen ist.
Puffersystem
In diesem Beispiel beträgt das Verhältnis zwischen dissoziierten und undissoziierten Essigsäuremolekülen 1 zu 237. Dies ändert sich aber, wenn man den pH-Wert erhöht und so einen Puffer erzeugt. So beträgt am Punkt pH = pKs = 4,75 das Verhältnis genau 1 zu 1. Dies ist der optimale Pufferbereich, da hier eine gegebene absolute Änderung der Essigsäure- und Acetatkonzentration das Verhältnis zwischen Essigsäure- und Acetatkonzentration und damit den pH-Wert am wenigsten ändert (siehe Henderson-Hasselbalch-Gleichung).
Der Essigsäure-Acetatpuffer ist ein bedeutendes Puffersystem für biochemische Systeme im sauren Bereich, da es einen günstigen pKA von 4,75 hat und die beteiligten Komponenten für die meisten Organismen und Biomoleküle nicht schädlich sind. Er ist ein geschlossenes Puffersystem, das heißt die entstehende konjugierte Säure/Base verbleibt in der Lösung und wird nicht wie z. B. beim Hydrogencarbonatpuffer aus dem System eliminiert.
Essigsäure oxidiert an der Luft vollständig unter Hitzeentwicklung zu Wasser und Kohlenstoffdioxid. Dies geschieht bei Raumtemperatur jedoch nur extrem langsam.
Unedle Metalle wie Magnesium, Calcium, Zink oder Eisen lösen sich in verdünnter Essigsäure unter Bildung wasserlöslicher Acetate und Freisetzung von Wasserstoff auf.
Mit Kupfer reagiert die Essigsäure in Gegenwart von Sauerstoff (Luft) zu Kupferacetat, einem grünen, gesundheitsschädlichen Salz, das besser unter dem Namen „Grünspan“ bekannt ist.
Essigsäure reagiert mit Ethanol säurekatalysiert zu Essigsäureethylester, einem viel verwendeten Lösemittel. Wird 1-Pentanol statt Ethanol verwendet, erhält man Essigsäureamylester, einen stark riechenden Ester. Salicylsäure lässt sich ebenfalls mit Essigsäure verestern. Dabei entsteht Acetylsalicylsäure, der Wirkstoff des Aspirins.
Essigsäure reagiert bei 800 °C unter Dehydratisierung zu Essigsäureanhydrid.
Essigsäure wird in verdünnter Form auch zum Kalklösen verwendet (siehe Essig). Die Reaktionsgleichung sieht folgendermaßen aus:
Sicherheitstechnische Kenngrößen
Reine Essigsäure gilt als entzündliche Flüssigkeit. Oberhalb der Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 40 °C.[1] Der Explosionsbereich liegt zwischen 4 Vol% (100 g/m3) als untere Explosionsgrenze (UEG) und 17 Vol% (430 g/m3) als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 485 °C.[12] Der Stoff fällt somit in die Temperaturklasse T1.
Die Einstufung und Kennzeichnung nach den Gefahrgutvorschriften hängt von der Konzentration ab. [1] Essigsäure, Eisessig oder Lösungen mit mehr als 80 Masse-% Säure werden der Gefahrgutklasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet. Als Nebengefahr muss die Gefahrgutklasse 3 (Entzündbare Flüssigkeiten) mit gekennzeichnet werden (Gefahrzettel 8/3). Lösungen mit mindestens 50 Masse-% und höchstens 80 Masse-% Säure werden nur noch der Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel 8). Für Lösungen mit mehr als 10 Masse-% und weniger als 50 Masse-% Säure gilt die Klasse 8 (Ätzende Stoffe) mit der Verpackungsgruppe III (geringe Gefährlichkeit) (Gefahrzettel: 8).
Verwendung
Essigsäure hat eine große Bedeutung als Geschmacksstoff. Essigsäure (E 260) und ihre Salze Kaliumacetat (E 261), Natriumacetat (E 262) und Calciumacetat (E 263) werden als Säuerungsmittel für Obst und Gemüse in Dosen und Gläsern (0,5–3 % Essigsäure), bei Fisch in allen Variationen, Konserven, verschiedenste Marinaden, Feinkostsalaten, Mayonnaisen, Salatsoßen zusammen mit Sorbinsäure (E 200) oder Benzoesäure (E 210) und für das Einlegen und Abwaschen von frischem Fleisch verwendet.
Der bakterizide Effekt der Essigsäure besteht darin, dass durch den veränderten pH-Wert physiologische Prozesse unterbunden werden und auch Eiweiße denaturieren.
Fast ein Fünftel der Weltproduktion an Essigsäure wird für die Herstellung von PET-Flaschen verbraucht.[13]
Essigsäure wird außerdem bei der Produktion von Kosmetikartikel (Cremen, Seifen) eingesetzt.
Salze der Essigsäure (Acetate)
- Hauptartikel: Acetate
Die Salze der Essigsäure werden als Acetate bezeichnet. Es sind zumeist farblose kristalline Salze, die in ihren Kristallgittern (Ionengittern) das Acetat-Anion (CH3COO−) enthalten.
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Essigsäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 4. Feb. 2008 (JavaScript erforderlich)
- ↑ pKa Data Compiled by R. Williams
- ↑ Eintrag zu CAS-Nr. 64-19-7 im European chemical Substances Information System ESIS
- ↑ Acetic acid bei ChemIDplus
- ↑ Essigsäure als Nebenprodukt der technischen Herstellung von Holzkohle
- ↑ McDonald, R.A.; Shrader, S.A.; Stull, D.R., Vapor Pressures and Freezing Points of 30 Organics, J. Chem. Eng. Data 4 (1959) 311–313
- ↑ a b NIST Chemistry WebBook http://webbook.nist.gov/chemistry/
- ↑ a b c d Martin, J.F.; Andon, R.J.L., Thermodynamic properties of organic oxygen compounds. Part LII. Molar heat capacity of ethanoic, propanoic, and butanoic acids, J. Chem. Thermodynam. 14 (1982) 679-688
- ↑ Weltner W., Jr., The vibrational spectrum, associative and thermodynamic properties of acetic acid vapor, J. Am. Chem. Soc. 77 (1955) 3941-3950
- ↑ Steele, W.V.; Chirico, R.D.; Cowell, A.B.; Knipmeyer, S.E.; Nguyen, A., Thermodynamic properties and ideal-gas enthalpies of formation for 2-aminoisobutyric acid (2-methylalanine), acetic acid, (4-methyl-3-penten-2-one), 4-methylpent-1-ene, 2,2'-bis(phenylthio)propane, and glycidyl phenyl ether (1,2-epoxy- 3-phenoxypropane), J. Chem. Eng. Data, 42 (1997) 1052-1066
- ↑ a b Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, 300
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003
- ↑ "Wasser statt Säure", Beitrag des Deutschlandfunks vom 17.9.2008 in der Rubrik "Forschung aktuell"
Weblinks
Ameisensäure | Essigsäure | Propionsäure | Buttersäure | Valeriansäure | Capronsäure | Önanthsäure | Caprylsäure | Pelargonsäure | Caprinsäure | Undecansäure | Laurinsäure | Tridecansäure | Myristinsäure | Pentadecansäure | Palmitinsäure | Margarinsäure | Stearinsäure | Nonadecansäure | Arachinsäure | Heneicosansäure | Behensäure | Tricosansäure | Lignocerinsäure | Pentacosansäure | Cerotinsäure | Heptacosansäure | Montansäure | Nonacosansäure | Melissinsäure
Wikimedia Foundation.