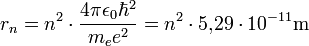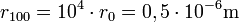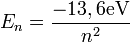- Rydberg-Physik
-
Ein Rydberg-Zustand (nach Johannes Rydberg) ist ein quantenmechanischer Zustand eines Atoms, Ions oder Moleküls, bei dem das äußerste Elektron wesentlich weiter vom Zentrum entfernt ist als im Grundzustand.
Inhaltsverzeichnis
Kennzeichen
Von diesem Zustand spricht man, wenn in einem Atom das Elektron eine sehr hohe Hauptquantenzahl n ≈ 100 hat. Dann hat es in Kernnähe – auch im Bereich, wo sich (außer bei Wasserstoff) die anderen (Rumpf-)Elektronen befinden – nur eine sehr geringe Aufenthaltswahrscheinlichkeit, und daher nur geringe Wechselwirkung mit dem Kern und den anderen, weiter innen liegenden Elektronen.
Beim Rydberg-Zustand eines Moleküls ist das äußerste Elektron in einem Molekülorbital, welches aus Atomorbitalen aufgebaut ist, die nicht zur Valenzschale des Moleküls gehören.
Die Energie eines Elektrons in einem Rydbergzustand liegt nur unwesentlich unter dem Vakuumniveau, und ist damit wesentlich höher als die Energie von weiter innen liegenden Elektronen, die eine größere Bindungsenergie haben. Das bedeutet aber auch, dass das entsprechende Elektron sehr einfach vom Atom getrennt (ionisiert) werden kann.
Diese hochliegenden Energieniveaus können durch elektronische Anregung (beispielsweise mit Strahlung passender Wellenlänge) besetzt werden. Rydberg-Zustände können aber auch entstehen, wenn ein Ion ein Elektron einfängt, beispielsweise, wenn dieses nahe an eine Oberfläche kommt und ein Elektron von der Oberfläche auf das Ion übertritt.
Größenverhältnisse
Bei Elektronen in weit vom Kern entfernten Rydbergzuständen können viele Eigenschaften durch die klassische Physik, d.h. ohne Berücksichtigung der Quantenphysik beschrieben werden. Dies folgt unmittelbar aus dem Korrespondenzprinzip, das besagt, dass für große Quantenzahlen n die quantenmechanische Beschreibung in die klassische übergeht. Deshalb liefert das Bohrsche Atommodell bei einem Rydberg-Wasserstoffatom gute Ergebnisse. Für den Abstand Proton-Elektron gilt:
Dadurch werden Rydbergatome sehr groß:
Die größten erreichten Quantenzahlen liegen bei n ≈ 500 mit Atomdurchmessern von fast einem Millimeter.
Bindungsenergien
Je weiter das Elektron vom Proton entfernt ist, desto schwächer ist es gebunden. Aus der notwendigen Ablöseenergie
folgt, dass bei n = 100 thermische Energien ausreichen, um das Elektron endgültig abzutrennen. Aus diesem Grund kann man so hoch angeregte Atome nur im Hochvakuum herstellen und „aufbewahren“. Sie entstehen auch auf natürliche Weise in den obersten Schichten der Atmosphäre.
Verweildauer
Rydbergatome sind klassische Beispiele für eine Besetzungsinversion, weil alle tieferen Zustände leer sind. Es kann sehr lange dauern, bis das Elektron auf die nächsttiefere Schale mit der Quantenzahl n-1 springen kann. Der Grund sind die Auswahlregeln und die sehr geringe räumliche Überlappung der Wellenfunktionen benachbarter Bahnen.
Beispiel
Im Wasserstoffatom ist die 1s-Schale die Valenzschale. Für das H2-Molekül lassen sich aus den 1s-Atomorbitalen der beiden Atome die Molekülorbitale σ und σ * konstruieren. Jedoch lassen sich auch aus den im Atom unbesetzten 2s-, 2p-, 3s-, ...-Atomorbitalen derartige Molekülorbitale aufbauen, die dann als Rydberg-Zustände bezeichnet werden.
Weblinks
Literatur
H.Dittmar-Ilgen: Erzeugung und Manipulation klassischer Elektron-Orbitale; Naturwissenschaftliche Rundschau 4/2006, S. 206 (H. Maeda; Science 307, 1757 (2005))
Vgl. auch Rydberg-Konstante.
Wikimedia Foundation.