- SPFC
-
Die Polymerelektrolytbrennstoffzelle (engl. Polymer Electrolyte Fuel Cell, PEFC, auch Protonenaustauschmembran-Brennstoffzelle, engl. Proton Exchange Membrane Fuel Cell, PEMFC oder Feststoffpolymer-Brennstoffzelle, engl. Solid Polymer Fuel Cell, SPFC[1]) ist eine Niedrigtemperatur-Brennstoffzelle.
Inhaltsverzeichnis
Geschichte
Die PEMFC „wurde Anfang der 60er Jahre bei General Electric von Thomas Grubb und Leonard Niedrach entwickelt. Das erste Mal zum Einsatz kam die PEM Mitte der 60er Jahre in dem amerikanischen Raumflugprojekt Gemini.“ (Zitat Hobein RWTH Aachen)
Prinzip
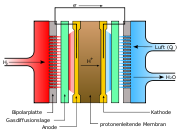
Unter Verwendung von Wasserstoff (H2) und Sauerstoff (O2) wird chemische in elektrische Energie umgewandelt. Der elektrische Wirkungsgrad beträgt je nach Arbeitspunkt etwa 60 %. Als Elektrolyt dient dabei normalerweise eine feste Polymermembran, beispielsweise aus Nafion. Die Betriebstemperatur liegt im Bereich von 60-120°C. Die Membran ist beidseitig mit einer katalytisch aktiven Elektrode beschichtet, einer Mischung aus Kohlenstoff (Ruß) und einem Katalysator, häufig Platin oder ein Gemisch aus Platin - Ruthenium (PtRu-Elektroden), Platin - Nickel (PtNi-Elektroden), oder Platin - Cobalt (PtCo-Elektroden). H2-Moleküle dissoziieren auf der Anodenseite und werden unter Abgabe von zwei Elektronen zu je zwei Protonen oxidiert. Diese Protonen diffundieren durch die Membran. Auf der Kathodenseite wird Sauerstoff durch die Elektronen, die zuvor in einem äußeren Stromkreis elektrische Arbeit verrichten konnten, reduziert; zusammen mit den durch den Elektrolyt transportierten Protonen entsteht Wasser. Um die elektrische Arbeit nutzen zu können, werden Anode und Kathode an den elektrischen Verbraucher angeschaltet.
Reaktionsgleichungen
Gleichung Anode 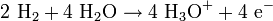
Oxidation / ElektronenabgabeKathode 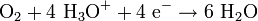
Reduktion / ElektronenaufnahmeGesamtreaktion 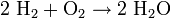
Redoxreaktion / ZellreaktionDer innere Ladungstransport erfolgt mittels Oxonium-Ionen. Auf der Anodenseite benötigt die Reaktion Wasser, welches sie auf der Kathodenseite wieder abgibt. Um den Wasserbedarf auf der Anodenseite zu decken, ist ein aufwändiges Wassermanagement erforderlich. Realisiert wird dies unter anderem durch Rückdiffusion durch die Membran und Befeuchtung der Edukte.
Anwendungsbereiche
Als Hauptanwendungsgebiete sind mobile Anwendungen ohne Nutzung der Abwärme, etwa in Brennstoffzellenfahrzeugen, U-Booten, Raumschiffen oder Akkuladegeräten für unterwegs zu sehen, auch stationäre Kleinanlagen mit einem Abwärmeniveau um 60 – 80 °C sind möglich. Um eine technisch relevante elektrische Spannung zu erzielen, werden mehrere Zellen (zehn bis mehrere hundert) zu einem so genannten Stack hintereinander geschaltet. Die Temperaturregelung des Stacks erfolgt in einem eigenen zusätzlichen Kühlkreislauf.
CO-Toleranz
Da die Reaktionen bei relativ niedrigen Temperaturen (60 °C - 120 °C) ablaufen, stellt die Toleranz gegen Kohlenmonoxid (CO) ein Problem dar. Die CO-Konzentration der Kathoden-seitig zugeführten Luft sowie das auf der Anoden-Seite zugeführte Wasserstoff-reiche Gasgemisch sollte bei Pt-Elektroden deutlich unter 10 ppm und bei PtRu-Elektroden deutlich unter 30 ppm liegen. Andernfalls werden zu viele katalytisch aktive Zentren der Membranoberfläche durch CO-Moleküle blockiert. Die Sauerstoff-Moleküle bzw. Wasserstoff-Moleküle können nicht mehr adsorbieren und die Reaktion bricht in kürzester Zeit zusammen. Durch das Spülen der Brennstoffzelle mit reinem Inertgas oder reinem Wasserstoff kann das CO wieder von der Membran entfernt werden. CO führt jedoch auch bereits innerhalb der Toleranzbereiche zu einer beschleunigten, irreversiblen Alterung der Membran.
Ziel der aktuellen Forschung ist daher, auch die CO-Toleranz der Membranen zu erhöhen. Ein anderer Lösungsansatz ist die Entwicklung von Hochtemperatur-PEMFCs die bei bis zu 200 °C arbeiten. Bedingt durch die deutlich höhere Temperatur beträgt die CO-Toleranz bis zu 1 %. Problematisch ist derzeit noch ein geeignetes Ionomer für diesen Temperaturbereich zu finden. Bei Nafion steigt der elektrische Widerstand zu stark an und es verliert seine Eigenschaft Protonen leiten zu können. Einsetzbar sind beispielsweise Polyimide wie Polybenzimidazol (PBI), das Phosphorsäure als Elektrolyt bindet. Technisch problematisch kann bei zu hohem Wassergehalt im Brenngas der Phosphorsäureaustrag sein.
Schwefelgehalt
Schwefel und Schwefelverbindungen (hier insbesondere Schwefelwasserstoff) sind starke Katalysatorgifte. Verursacht wird dies durch eine starke Chemisorption auf der katalytisch aktiven Membranoberfläche. Es erfolgt eine nicht reversible Zerstörung. Die Konzentration im Gasstrom muss im unteren zweistelligen ppb-Bereich liegen um eine solche Schädigung zu vermeiden.
Vor- und Nachteile gegenüber anderen Brennstoffzellen
Vorteile einer PEM sind:
- fester Elektrolyt (keine aggressiven Flüssigkeiten die auslaufen könnten)
- weist eine hohe Stromdichte auf
- hat ein gutes dynamisches Verhalten
- Auf der Kathodenseite kann Luft verwendet werden (kein Reingas erforderlich)
- Der Elektrolyt ist CO2-beständig
Nachteile sind:
- Sehr empfindlich gegen Verschmutzungen durch CO, NH3 und Schwefelverbindungen im Brenngas
- Aufwändiges Wassermanagement
- Anlagenwirkungsgrad eher niedrig
Einzelnachweise
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Polymerelektrolytmembran-Brennstoffzelle im Lexikon der Physik, abgerufen am 05. Januar 2009
Weblinks
Wikimedia Foundation.