- STED Mikroskop
-
Ein STED-Mikroskop (Stimulated Emission Depletion) ist ein Konfokalmikroskop, dessen Auflösung nicht beugungsbegrenzt ist, und das nach dem RESOLFT-Prinzip arbeitet. Es wurde von Stefan Hell erfunden und in seiner Arbeitsgruppe am Max-Planck-Institut für biophysikalische Chemie in Göttingen weiterentwickelt.
Aufgrund von Beugung ist die Auflösung herkömmlicher Fernfeldmikroskope begrenzt. Lateral lassen sich daher keine Strukturen abbilden, die kleiner als die halbe verwendete Wellenlänge sind. Axial liegt die Grenze bei einem Viertel der Wellenlänge. Gute Konfokalmikroskope können Strukturen abbilden, die kleiner als 190 nm (lateral) sind. Beim STED-Mikroskop wird durch Ausnutzen eines sättigbaren optischen Übergangs die Auflösung nicht mehr durch Beugung begrenzt. Es konnte bereits eine Auflösung von 5,8 nm (lateral) demonstriert werden.[1]
Das STED-Mikroskop und die Gruppe um Stefan Hell wurden für Ihre Ergebnisse im Jahr 2006 mit dem Deutschen Zukunftspreis ausgezeichnet.
Inhaltsverzeichnis
Grundlagen
Beim STED-Mikroskop handelt es sich um eine spezielle Variante eines Fluoreszenz-Laser-Raster-Mikroskops. Um das Funktionsprinzip besser zu verstehen, ist es notwendig auf die wichtigsten Gesichtspunkte von Fluoreszenz, stimulierter Emission und der Laser-Raster-Mikroskopie einzugehen.
Fluoreszenz und stimulierte Emission
Bei der STED-Mikroskopie werden sogenannte Fluoreszenzfarbstoffe zum Markieren einzelner Bereiche einer Probe eingesetzt. Solche Farbstoffe können durch Absorption eines Photons aus dem Grundzustand in einen höher angeregten Zustand übergehen. Daraus können sie nach kurzer Zeit spontan durch Aussenden eines Photons höherer Wellenlänge wieder in den Grundzustand zurückkehren. Diese spontane Abstrahlung von Licht nennt man Fluoreszenz. Durch geeignete Farbfilter kann das Fluoreszenzlicht vom Anregungslicht getrennt werden.
Ein angeregtes Farbstoffmolekül kann neben der spontanen Emission auch durch stimulierte Emission wieder in den Grundzustand zurückkehren. Dazu wird es mit einem Photon mit der gleichen Wellenlänge wie das Fluoreszenzlicht bestrahlt. Das angeregte Farbstoffmolekül kann so zum Übergang in den Grundzustand durch Aussenden eines Photons gleicher Wellenlänge stimuliert werden.
Fluoreszenz-Laser-Raster-Mikroskopie
Für die Untersuchung in einem Fluoreszenzmikroskop werden Fluoreszenzfarbstoffe an bestimmte Stellen einer Probe gebracht. Wird die Probe nun mit Licht geeigneter Wellenlänge angestrahlt, so werden die Farbstoffe zur Fluoreszenz angeregt, und man erhält ein leuchtendes Bild der Probe. Im Laser-Raster-Mikroskop wird ein Laser-Strahl auf einen kleinen Punkt in der Probe fokussiert und die angeregte Fluoreszenz in diesem Bereich detektiert. Durch Bewegen (Scanning, Rastern) des Fokus über die Probe wird punktweise ein Abbild der gefärbten Bereiche erstellt. Die Auflösung dieses Verfahrens ist durch das Abbe-Gesetz begrenzt.
Funktionsprinzip des STED-Mikroskops
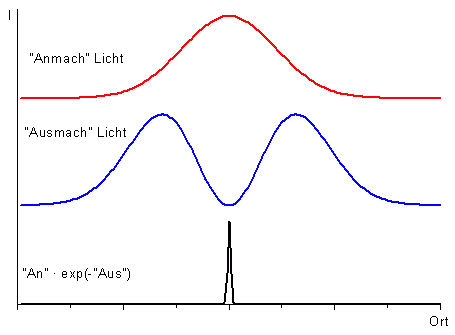
Das STED-Mikroskop erreicht eine bessere Auflösung, indem sichergestellt wird, dass das Licht aus einem Bereich der Probe kommt, der kleiner als die optische Auflösung ist. Das geschieht, indem nach Anregung (An, rot im Bild) gezielt die angeregte Stelle mit einem zweiten Lichtstrahl (Aus, blau im Bild) abgeregt wird. Dieser zweite Lichtstrahl wird mit einer Intensitätsverteilung versehen, die in der Mitte des Strahls Null ist. An dieser Stelle findet daher keine stimulierte Emission statt (schwarz im Bild). Die Intensität des anregenden und abregenden Strahls wird so eingestellt, dass der Bereich, in dem keine stimulierte Emission stattfindet, kleiner ist als das optische Auflösungsvermögen. Beim Scannen der Probe erfasst man somit jeweils einen leuchtenden Fleck, der kleiner als das optische Auflösungsvermögen ist.
Anwendung in der Mikrobiologie
Ein bedeutendes Problem gleich welcher lichtmikroskopischen Technik ist der mangelnde Kontrast von Zellbestandteilen. Schon lange benutzt man deshalb fluoreszente Moleküle, die z. B. mit gentechnischen Methoden oder mittels Antikörpern selektiv an bestimmte Moleküle einer Zelle geheftet werden können. Man kann zum Beispiel Farbstoffe nur an Mitochondrien anbauen. Beleuchtet man nun eine Stelle der so präparierten Zelle mit einem fokussierten Laserstrahl und erhält von dort Fluoreszenz, so waren an genau dieser Stelle Farbstoffmoleküle und damit auch Mitochondrien. Um ein vollständiges Bild zu erhalten, wird die Probe Punkt für Punkt abgescannt.
Vor der Erfindung der STED-Mikroskopie bestand das Problem, dass der Anregungsstrahl aufgrund der Abbeschen Beugungsgrenze nicht beliebig klein fokussiert werden kann. Man regt also immer alle Moleküle, die sich gerade im Brennfleck befinden an und kann daher nicht entscheiden, von welchem Molekül die Fluoreszenz gerade kommt. Somit können Strukturen, die kleiner sind als die Ausdehnung des Laserfokus nicht unterschieden werden.
Wie oben skizziert, wird bei der STED-Mikroskopie die leuchtende Stelle stark verkleinert. Zunächst wird, genau wie bei der konventionellen Mikroskopie, eine minimal 200 nm (Durchmesser) kleine Fläche mittels eines fokussierten Lichtstrahls angeregt. Ein zweiter Lichtstrahl niedrigerer Energie wird wenige Picosekunden später dem Anregungsstrahl hinterhergeschickt, noch bevor die angeregten Farbstoffmoleküle von sich aus fluoreszieren können. Wo dieser Strahl auf einen angeregten Fluoreszenzmarker trifft, regt er diesen wieder ab. Indem der zweite Strahl ringförmig um die vorher angeregte Stelle gelegt wird, kann ein Großteil der angeregten Fläche (die Ränder) wieder abgeregt werden bevor es zur spontanen Emission von Fluoreszenz kommt. Somit lässt sich die emittierende Fläche - also das Zentrum des Rings - effektiv verkleinern. Die Detektion von Fluoreszenz erfasst dann nur diejenigen Markermoleküle, die nicht abgeregt wurden. Das kann theoretisch nur ein einzelnes Molekül sein, das sich vorher in der Mitte des Anregungsflecks befand. Die Ortsauflösung des optischen Detektors ist dabei gleichgültig.
In einem STED-Mikroskop lassen sich alle Präparate untersuchen, die mit Fluoreszenzfarbstoffen markierbar sind. Anders als bei Elektronenmikroskopen sind kein Vakuum und keine dünnen Schnitte erforderlich, da es sich um eine Fernfeld-Technik handelt. Die Proben erleiden keine Strahlenschäden, so dass sich auch lebende Zellen beobachten lassen[2].
Literatur
- T. A. Klar, S. Jakobs, M. Dyba, A. Egner and S. W. Hell : Fluorescence microscopy with diffraction resolution limit broken by stimulated emission. in: Proceedings of the National Academy of Sciences of the United States of America (Proc. Natl. Acad. Soc. USA.). Washington 97.2000,15, S.8206-8210. PMID 10899992 ISSN 0027-8424
- M. Dyba, S. W. Hell: Focal spots of size lambda/23 open up far-field florescence microscopy at 33 nm axial resolution. in: Physical Review Letters. Ridge 88.2002,16. 163901-1-163901-4 (Epub) PMID 11955234 ISSN 0031-9007
- K. I. Willig, S. O. Rizzoli, V. Westphal, R. Jahn, S. W. Hell: STED-microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. in: Nature. London 440.2006, 7086, S.935–939. PMID 16612384 ISSN 0028-0836
Weblinks
- Abteilung NanoBiophotonics am MPI für biophysikalische Chemie (englisch)
- Detailinformationen und Bilder zur STED-Mikroskopie (PDF-Datei)
- Hintergrundinformationen - Deutscher Zukunftspreis
Fußnoten
- ↑ Eva Rittweger, Kyu Young Han, Scott E. Irvine, Christian Eggeling, and Stefan W. Hell. STED microscopy reveals crystal colour centres wit nanometric resolution. (Nature Photonics, Online-Veröffentlichung, 22. Februar 2009) | doi:10.1038/nphoton.2009.2
- ↑ V. Westphal, S. O. Rizzoli, M. A. Lauterbach, D.Kamin, R. Jahn, S. W. Hell: Video-Rate Far-FieldOptical Nanoscopy Dissects Synaptic Vesicle Movement. in: Science. Washington 320.2008, S.246-249. ISSN 0036-8075
Wikimedia Foundation.