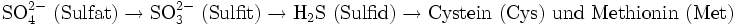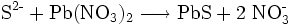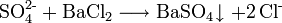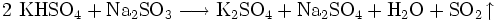- Schwefelstoffwechsel
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Schwefel, S, 16 Serie Nichtmetalle Gruppe, Periode, Block 16, 3, p Aussehen gelb CAS-Nummer 7704-34-9 ATC-Code D10AB02
Massenanteil an der Erdhülle 0,05 % Atomar Atommasse 32,065 u Atomradius (berechnet) 100 (88) pm Kovalenter Radius 102 pm Van-der-Waals-Radius 180 pm Elektronenkonfiguration [Ne] 3s2 3p4 Elektronen pro Energieniveau 2, 8, 6 1. Ionisierungsenergie 999,6 kJ/mol 2. Ionisierungsenergie 2252 kJ/mol 3. Ionisierungsenergie 3357 kJ/mol 4. Ionisierungsenergie 4556 kJ/mol 5. Ionisierungsenergie 7004,3 kJ/mol 6. Ionisierungsenergie 8495,8 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur orthorhombisch Dichte 2,07 g/cm3[1] Mohshärte 2 Magnetismus diamagnetisch Schmelzpunkt 388,36 K (115,21 °C) Siedepunkt 717,87 K (444,72 °C) Molares Volumen 15,53 · 10-6 m3/mol Verdampfungswärme 9,6 kJ/mol Schmelzwärme 1,7175 kJ/mol Dampfdruck 2,65 · 10-20 Pa bei 388 K Spezifische Wärmekapazität 710 J/(kg · K) Elektrische Leitfähigkeit 5,0 · 10-22 A/(V · m) Wärmeleitfähigkeit 0,269 W/(m · K) Chemisch Oxidationszustände ±2, 4, 6 Oxide (Basizität) SO2, SO3 (stark sauer) Normalpotential -0,48 V (S + 2e− → S2−) Elektronegativität 2,58 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 30S 1,178 s ε 6,138 30P 31S 2,572 s ε 5,396 31P 32S 95,02 %
Stabil 33S 0,75 %
Stabil 34S 4,21 %
Stabil 35S 87,32 d β− 0,167 35Cl 36S 0,02 %
Stabil 37S 5,05 min β− 4,865 37Cl 38S 170,3 min β− 2,937 38Cl 39S 11,5 s β− 6,640 39Cl 40S 8,8 s β− 4,710 40Cl NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Reizend (Xi) R- und S-Sätze R: 38 S: (2)-46 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Schwefel (lat. Sulphur [ˈzʊlfʊr] oder Sulfur, im Deutschen eventuell von indogerm. *suel- oder „schwelen“ abgeleitet) ist ein chemisches Element der Sauerstoffgruppe mit dem chemischen Symbol S. Er verbrennt an der Luft mit blauer Flamme zu stechend riechendem Schwefeldioxid. Schwefel kommt in Organismen unter anderem in Aminosäuren und Koenzymen vor, und spielt eine wichtige Rolle bei der anaeroben Energiegewinnung von Mikroorganismen.
Die Silbe „-thio-“ stammt vom griech. θείον = Schwefel.
Inhaltsverzeichnis
Modifikationen
Schwefel tritt in verschiedenen Modifikationen auf:
Fester Schwefel
- Die bei Raumtemperatur thermodynamisch stabilste Modifikation des Schwefels ist α-Schwefel, orthorhombisch kristallisierend (orthorhombischer Schwefel). Er ist geruch- und geschmackslos und hat die typische schwefelgelbe Farbe.
- Bei 95,6 °C liegt der Umwandlungspunkt zu β-Schwefel. Diese Schwefelmodifikation ist fast farblos und kristallisiert monoklin (monokliner Schwefel).
- Seltener ist der ebenfalls monoklin kristallisierende γ-Schwefel (Rosickyit).
Flüssiger Schwefel
- λ-Schwefel: S8-Ringe (gelb) (Schwefelblüte)
- π-Schwefel: Sn (6 ≤ n ≤ 25, n ≠ 8) niedermolekulare und größere Ringe
- μ-Schwefel: Sn (103 ≤ n ≤ 106) hochmolekulare Ketten
Fester Schwefel besteht aus S8-Molekülen, in denen die Schwefelatome in ringförmig in einer so genannten Kronenform angeordnet sind. Beim Erhitzen schmilzt der β-Schwefel, wobei auch andere Ringe (v. a. S6, S7, S12) temperaturabhäng auftreten. Bei weiterer Erhöhung der Temperatur brechen die Ringe durch thermische Anregung auf und bilden zunächst lange Ketten (Polymerisation, sog. λ-Übergang bei ca. 159 °C), diese verkürzen sich durch Zerfall bei steigender Temperatur. Neben diesen Schwefelketten liegen auch Ringe vor mit je acht Schwefelatomen vor. Am λ-Übergang ändern sich eine Reihe physikalischer Eigenschaften (z. B. Viskosität, optische Absorption und damit auch die Farbe).
Gasförmiger Schwefel ist dunkelrot und besteht anfangs aus S8-Ringen, die bei höheren Temperaturen weiter aufbrechen, bis schließlich S2-Moleküle vorliegen. Ab etwa 1800 °C liegt Schwefelatome monomer vor.
In der Pharmazie verwendet man drei verschiedene Arten von Schwefelpulver:
- Sulfur praecipitatum, der sogenannte gefällte arsenfreie Schwefel in fein verteilter Form, das auch als Schwefelmilch bezeichnet wird. Angewendet wird es bei äußerlichen Hauterkrankungen.
- Sulfur depuratum, gereinigter und arsenfreier Schwefel, wird auch Schwefelblüten genannt. Es wird aus sublimiertem Schwefel gewonnen (der sublimierte Schwefel ist eine feinkristalline Schwefelblüte). Angewendet wird es als mildes Abführmittel.
- Sulfur colloidale, sogenannter Kolloidaler Schwefel (der feinste Schwefel), der in Salben eingesetzt wird.
Vorkommen
Schwefel kommt mit einem Massenanteil von 0,46 % in der gesamten Erde (8. Stelle der Elementhäufigkeit), von 0,048 % in der Erdhülle (15. Stelle der Elementhäufigkeit) und von 0,035 % in der kontinentalen Erdkruste (16. Stelle der Elementhäufigkeit) vor.
Elementarer Schwefel kommt in der Natur in mächtigen Lagerstätten z.B. in Sizilien, Polen, Irak, Iran, Louisiana, Texas und Mexiko vor.
Weitverbreitet ist Schwefel in sulfidischen Mineralen, wie Pyrit und Markasit FeS2, Kupferkies CuFeS2, Bleiglanz PbS und Zinkblende ZnS. Die meisten Metalle (v.a. Schwermetalle) kommen in der Natur als schwerlösliche Sulfide vor.
Auch in Form von Sulfaten, wie Sulfat-Ionen in den Meeren (etwa 0,9 g/L), Gips (CaSO4 · 2 H2O), Schwerspat (BaSO4) und anderen schwer wasserlöslichen Sulfaten kommt Schwefel natürlich vor.
Eine wichtige Quelle für Schwefel sind fossile Brennstoffe wie Erdöl, Erdgas und Kohle. Vor allem Erdgas enthält relativ viel Schwefelwasserstoff (H2S). Es ist darin durch Abbau schwefelhaltiger organischer Stoffe entstanden.
Schwefel als Mineral
Schwefel tritt gediegen, also in elementarer Form, als Schwefelblüte (Gelber Schwefel) in der Natur auf. Er kristallisiert unterhalb etwa 95 °C im orthorhombischen Kristallsystem (α-Schwefel), hat eine Dichte von 2,0 bis 2,1, eine Härte von 1,5 bis 2,5 und eine hell- bis dunkelgelbe Farbe, sowie eine weiße Strichfarbe. Meist zeigt er hellgelbe prismen- oder pyramidenförmige Kristalle, die sich auf Gesteinsflächen aus schwefelreichen Gasen durch unvollständige Oxidation von Schwefelwasserstoff (H2S) oder Reduktion von Schwefeldioxid (SO2) bilden. Oberhalb etwa 95 °C kristallisiert Schwefel monoklin (β-Schwefel). Diese Form wandelt sich unterhalb 95 °C rasch in die orthorhombische α-Form um.
Reiner Schwefel ist relativ selten, wird allerdings in großen Mengen bei Vulkanausbrüchen freigesetzt. Er findet sich in Vulkanschloten oder an anderen Postvulkanischen Erscheinungen. Schwefel kommt aber auch in derber Form, das heißt, ohne mit bloßem Auge erkennbare Kristalle vor, insbesondere in Sedimenten oder Sedimentgesteinen. Häufig findet er sich in Evaporiten (Salzgesteinen), wo er meistens durch Reduktion von Sulfaten entsteht.
Charakteristisch für das Mineral sind neben der geringen Härte die Farbe und der niedrige Schmelzpunkt 112,8 °C (α-S) beziehungsweise 119,2 °C (β-S). Siedepunkt bei 444,7 °C
Gewinnung
Früher bildete das gediegene Mineral eine wichtige Quelle für Schwefel.
An Vulkanen und in ihrer Nähe kommen Fumarolen vor, die mit ihren Gasen neben Schwefelwasserstoff auch gasförmigen, elementaren Schwefel ausstoßen, der beim Abkühlen an der Austrittsstelle kondensiert und über 95 °C monokline, unterhalb 95 °C orthorhombische Kristalle bildet. Im Mittelalter waren Ablagerungen von solchen Fumarolen auf Island, etwa Námafjall, eine wichtige Quelle für die Herstellung von Schießpulver in ganz Europa.
3,5 Millionen Tonnen wurden jährlich mit Hilfe des von Hermann Frasch entwickelten Frasch-Verfahrens abgebaut, hauptsächlich in den USA und in Polen. Den größten Anteil machte jedoch aus Sulfiderzen gewonnener Schwefel aus: Aus dieser Quelle stammten etwa 50 Millionen Tonnen pro Jahr. Heute fällt der Schwefel in großen Mengen als Abfallprodukt bei der Entschwefelung von Erdöl mit Hilfe des Claus-Verfahrens an.
Biologische Bedeutung
Schwefel am Gipfel des VulcanoSchwefel ist in den Aminosäuren Cystein/Cystin und Methionin − und in allen darauf aufbauenden Peptiden, Proteinen, Koenzymen und prosthetischen Gruppen − in Form von Thiolgruppen (Oxidationsstufe +II) oder Thioethergruppen enthalten. Weiterhin ist er in einigen Kofaktoren (Biotin, Thiaminpyrophosphat) in heterozyklischer Bindung enthalten. Schwefel ist damit ein essentielles Element lebender Zellen. Disulfidbrückenbindungen sind weit verbreitet und tragen zur Ausbildung und Stabilisierung von Proteinstrukturen bei. Auch in oxidierter Form spielt Schwefel in der Aminosulfonsäure Taurin (Oxidationsstufe +IV) eine wichtige biologische Rolle.
Einige Untergruppen der Proteobakterien, die Grünen Schwefelbakterien und einige Cyanobakterien sind in der Lage, Photosynthese zu betreiben, indem sie Schwefelwasserstoff (H2S) oder elementaren Schwefel an Stelle von Wasser (H2O) als Elektronendonator für die Reduktion von CO2 verwenden, siehe dazu exemplarisch Thiomargarita namibiensis. Diese Art von Photosynthese findet unter Sauerstoffausschluss statt.
Pflanzen nehmen Schwefel über die Wurzeln in Form von Sulfat-Ionen auf, die dann zu Sulfid reduziert und anschließend zur Bildung von Cystein und anderen organischen Schwefelverbindungen genutzt werden.
Schwefel-Assimilation in Pflanzen
Der Schwefel wird bei Gefäßpflanzen als Sulfat über die Wurzeln aufgenommen. Die Assimilation findet zwar auch in den Wurzeln statt, die Hauptmenge des Sulfats wird jedoch über die Xylemelemente in die Blätter transportiert und dort im Chloroplasten reduziert. Da Moose im Gegensatz zu Gefäßpflanzen in der Regel keine Stütz- und Leitgewebe ausbilden, nehmen sie das Sulfat in der Regel mit ihrem Protonema auf. In beiden Fällen erfolgt die Sulfatassimilation nach folgender genereller Sequenz:
Wie Genomvergleiche ergeben haben, besitzen einfach gebaute Pflanzen wie Physcomitrella patens und Selaginella moellendorffii sieben verschiedene Sulfattransporter, während der Reis 13 und die Acker-Schmalwand 14 verschiedene Sulffattransporter besitzen [3]. Auch hinsichtlich der Enzymausstattung gibt es Unterschiede zwischen Moosen und Angiospermen. So besitzt das Laubmoos P. patens auch APR-Enzyme, die die Umwandlung von Sulfat zu Sulfit katalysieren, ohne Eisen-Schwefel-Cluster [4]. Damit sind sie in ihrer Proteinsequenz den PAPR-Enzymen aus Bakterien und Pilzen ähnlich.
Bei Pflanzen wurde bei Zunahme von Schwefel in der Umwelt eine Schwefel-induzierte Resistenz, das ist eine verstärkte Abwehrfähigkeit gegenüber Pathogenen und Herbivoren, beobachtet.
Ökologische Aspekte
Bei der Energiegewinnung aus fossilen Brennstoffen wie Steinkohle, Braunkohle und Erdöl werden große Mengen Schwefeldioxid SO2 freigesetzt. Dieses bleibt als Gas oder im Wasser der Wolken gelöst zunächst in der Atmosphäre. Dabei bildet es einen wichtigen Bestandteil des gesundheitsgefährdenden Smogs. Abgebaut werden kann es, indem von Sauerstoff zu Schwefeltrioxid SO3 oxidiert wird und dann als Schwefelsäure H2SO4 mit dem Regen ausgespült wird.[5] Daraus ergibt sich ein weiteres Problem, da diese als Bestandteils des Sauren Regens zur Versauerung der Böden beiträgt. Seit den 1970er Jahren sind darum Maßnahmen zur Rauchgasentschwefelung in Deutschland gesetzlich vorgeschrieben. Daneben wird seit einigen Jahren die Entschwefelung von Fahrzeugkraftstoffen (vor allem Diesel) forciert. Durch diese Vorschriften und ihre Umsetzungen konnten die Schwefelemissionen seit den 1960er Jahren drastisch reduziert werden. Dies spiegelt sich auch deutlich in der Tatsache wider, dass in der Landwirtschaft die Schwefeldüngung notwendig wird. Dies war zuvor nicht relevant.
Verwendung
Schwefel wird sowohl in der chemischen Industrie als auch in der pharmazeutischen Industrie genutzt, unter anderem zur Produktion von Schwefelsäure, Farbstoffen, Insektiziden und Kunstdüngern.
Der pharmazeutische Nutzen von Schwefel war bereits im Altertum bekannt. Innerlich wurde Schwefel als Laxans (Abführmittel) eingesetzt. Er reizt die Darmschleimhaut. Der dabei durch Bakterien erzeugte Schwefelwasserstoff regt die Peristaltik an. Äußerlich kamen Schwefelrezepturen bei Hauterkrankungen wie Akne, Ekzemen, Krätze, Mykosen u. a. zum Einsatz. Heute findet Schwefel in der Dermatologie nur noch selten Verwendung, ist aber noch nicht vollständig aus der pharmazeutischen Literatur verschwunden. Nach wie vor gibt es pharmazeutische Zubereitungen, die als Wirk- bzw. Hilfsstoff Schwefel enthalten. In der klassischen Homöopathie ist Sulfur eines der so genannten großen Mittel.
In der Schwerindustrie ist Schwefel als Legierungselement für Stahl bedeutend. Automatenstähle sind oft schwefellegiert, da Schwefel zu erhöhtem Spanbruch führt.
Schwefel findet auch bei der Herstellung von Schwarzpulver, als Salpeterschwefel in der Feuerwerkerei, oder bei anderen Explosivstoffen Verwendung.
Schwefelverbindungen
Sulfide
- Schwefelwasserstoff und Metalloxide oder -hydroxide bilden Sulfide (Salze der schwachen Säure Schwefelwasserstoff)
- Zinnober (HgS)
- Disulfan (Dihydrogendisulfid) und höhere Sulfane
Oxide
- Schwefeloxide, wie Schwefeldioxid und Schwefeltrioxid,
Sauerstoffsäuren und Salze
Säuren des Typus H2SOn Oxidationsstufe
des SchwefelsStruktur Säuren Salze Beispiele +II Sulfoxylsäure
H2SO2Sulfoxylate +IV Schweflige Säure
H2SO3Sulfite +VI Schwefelsäure
H2SO4Sulfate - Natriumsulfat,
- Ammoniumsulfat,
- Calciumsulfat (CaSO4 · 2H2O Gips)
+VI Peroxo(mono)schwefelsäure
H2SO5Peroxosulfate - ein starkes Oxidationsmittel
Säuren des Typus H2S2On mittlere Oxidationsstufe
des SchwefelsStruktur Säuren Salze Beispiele +I Thioschwefelige Säure
H2S2O2Thiosulfite
(unbekannt)+II Thioschwefelsäure
H2S2O3Thiosulfate - Natriumthiosulfat, ein Fixiersalz
+III Dithionige Säure
H2S2O4Dithionite - Natriumdithionit,
ein Reduktions- bzw. Bleichmittel
+IV Dischweflige Säure
H2S2O5Disulfite +V Dithionsäure
H2S2O6Dithionate +VI Dischwefelsäure
H2S2O7Disulfate +VI Peroxodischwefelsäure
H2S2O8Peroxodisulfate - Kaliumpersulfat,
ein starkes Oxidations- bzw. Bleichmittel
Nitride
- Schwefelnitride: S4N4, S2N2 und (SN)x
Halogenide
- Schwefelhalogenide: z. B. Schwefeldichlorid, Schwefeltetrachlorid, Dischwefeldichlorid und höhere Oligosulfanchloride (Vulkanisierung), Schwefelhexafluorid
Organoschwefelverbindung
In zahlreichen organischen Verbindungen kommt Schwefel gebunden vor und wird unter Organoschwefelverbindung ausführlicher beschrieben.
- Thiole (= Mercaptane)
- Thioether
- Heterocyclische Verbindungen, wie Thiophen
- Sulfoxide wie Dimethylsulfoxid als Lösungsmittel
- Sulfone
- Sulfonsäuren, deren Salze, die Sulfonate, zum Beispiel als Tenside dienen
Nachweis
Es existieren verschiedene Nachweisreaktionen für Schwefel. Schwefel wird in Verbindungen nach Reduktion durch elementares Natrium in Natriumsulfid überführt. Sulfid-Anionen weist man mit Blei-II-salzlösungen nach, wobei ein schwarzer Niederschlag von Blei-II-sulfid entsteht:
Beim Ansäuern von festen, also ungelösten Sulfiden entsteht zudem ein charakteristischer Geruch, nach faulen Eiern (Verdrängungsreaktion, Vorsicht: Das Gas Schwefelwasserstoff ist giftig; Einatmen vermeiden, Abzug!). Auch dieses Gas schwärzt Bleiacetatpapier.
Durch Oxidation schwefelhaltiger Verbindungen entstehen Sulfit und Sulfat. Letzteres weist man mit Barium-II-salzlösungen nach: Es entsteht ein weißer Niederschlag von Bariumsulfat:
Sulfit wird mit Kaliumhydrogensulfat nachgewiesen. Beim Verreiben der auf Sulfit zu prüfenden Substanz mit Kaliumhydrogensulfat entsteht das stechend riechende Schwefeldioxid. Für Natriumsulfit ergibt sich folgende Reaktionsgleichung:
Trivia
- Bei den mittelalterlichen Alchemisten symbolisierte der Löwe den Schwefel
- Nicht nur in der deutschen Literatur wird das Erscheinen des Teufels mit dem "Geruch von Schwefel" assoziiert, bzw. kündigt Schwefelgeruch das Erscheinen des Teufels an (vgl. auch die Rede von Hugo Chavez vor der UNO [6]). Dies ist zwar auch umgangssprachlich akzeptiert, fachlich aber falsch, da elementarer Schwefel keinen Geruch hat. Gemeint sind in der Regel besonders Schwefelverbindungen wie Schwefelwasserstoff oder der stechende Geruch von Schwefeldioxid.
Siehe auch
Einzelnachweise
- ↑ S. J. Rettig, J. Trotter: Refinement of the structure of orthorhombic sulphur, α-S8. In: Acta Crystallographica. Bd. C 43, 1987, S. 2260–2262.
- ↑ Eintrag zu CAS-Nr. 7704-34-9 im European chemical Substances Information System ESIS
- ↑ Stanislav Kopriva, Gertrud Wiedemann, Ralf Reski (2007): Sulfate Assimilation in Basal Land Plants – What Does Genomic Sequencing Tell Us? Plant Biology 9, 556–564. [1]
- ↑ Stanislav Kopriva, Kai Fritzemeier, Gertrud Wiedemann, Ralf Reski (2007): The Putative Moss 3'-Phosphoadenosine-5'-phosphosulfate Reductase Is a Novel Form of Adenosine-5'-phosphosulfate Reductase without an Iron-Sulfur Cluster. Journal of Biological Chemistry 282, 22930–22938 [2]
- ↑ Holleman-Wiberg: Lehrbuch der Anorganischen Chemie 102. Auflage, de Gruyter, Berlin, 2007.
- ↑ Der Spiegel, 20.09.2006[3]
Literatur
- R. Steudel (Hrsg.): Elemental Sulfur and Sulfur-Rich Compounds (part I & II). In: Topics in Current Chemistry. Vol. 230 & 231, Springer, Berlin 2003
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
Weblinks
- Mineralienatlas:Schwefel und Mineralienatlas:Mineralienportrait/Schwefel (Wiki)
- Schwefelkreislauf
- Schwefel
- Sulfur (engl.)
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase
Wikimedia Foundation.