- Sehpurpur
-
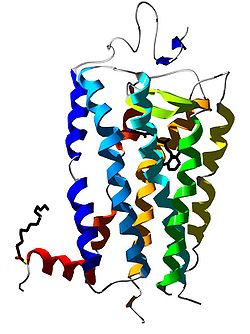
Rhodopsin Dreidimensionale Struktur des Backbones von Rhodopsin. In der Mitte ist das für die Signalkaskade wichtige 11-cis-Retinal zu sehen. Nach PDB 1L9H. Größe 348 Aminosäuren Struktur multipass Membranprotein Bezeichner Gen-Name RHO Externe IDs OMIM: 180380 UniProt: P08100 Rhodopsin (wegen seiner roten Farbe auch Sehpurpur genannt) ist ein Opsin, bei dem am ε-Amin des K296 11-cis-Retinal (Aldehyd des Retinols) als Imin kovalent gebunden ist. Es ist eines der Sehpigmente in der Retina der Augen von Wirbeltieren und in den Photorezeptoren von Evertebraten. Am Beginn des Sehprozesses führt der Einfall von Licht zu einer Isomerisierung des Retinals (11-cis-Retinal -> all-trans-Retinal). Hierfür wird nur ein Photon ausreichender Energie benötigt. Dadurch kommt es zu einer Konformationsänderung im Opsin, was über die Aktivierung des G-Proteins Transducin zur Auslösung der visuellen Signaltransduktion führt.
Es gibt verschiedene Photorezeptoren, die sich in ihrer Empfindlichkeit gegenüber bestimmten Wellenlängen unterscheiden. Im menschlichen Auge sind dies bei den Stäbchen das Rhodopsin und bei den Zapfenzellen das Iodopsin. Drei verschiedene Ausprägungen des Iodopsins bilden die Grundlage des Farbensehens und weisen nur geringe Differenzen in ihren Aminosäuresequenzen auf.
Rhodopsin ist der bekannteste und bestuntersuchte Vertreter einer Proteinfamilie von G-Protein gekoppelte Rezeptoren (GPCR). Das Charakteristische an dieser Familie sind sieben Transmembrandomänen und ein Rezeptor, der durch Anlagerung eines Liganden das G-Protein aktiviert (indem GTP an G-Protein angelagert wird und das in inaktivem Zustand dort befindliche GDP ersetzt). Bovines Rhodopsin war der erste GPCR, von dem eine durch Röntgenstrukturanalyse gewonnene Kristallstruktur vorlag. Er dient daher als Vorlage für Modelle anderer GPCRs, auch wenn die Übereinstimmung in der Primärstruktur teilweise sehr gering ist. Seit dem 21. Oktober 2007 ist aber auch eine Kristallstruktur des menschlichen β2-Adrenozeptors publiziert. Im Juni 2008 folgten Strukturen des β1-Adrenozeptors vom Truthuhn (Meleagris gallopavo) und des Rhodopsins des Japanischen Fliegenden Kalmars (Todarodes pacificus).
Ein Mangel an Vitamin A als Quelle des Retinals führt zu Nachtblindheit, Trockenheit des Auges (Xerophthalmie) sowie einer Hornhautentzündung (Keratitis) des Auges. Bei Kindern kann Vitamin-A-Mangel zur Erblindung führen. Dies tritt wegen der auf Reis basierenden Ernährung besonders häufig in Ländern der dritten Welt auf. Der Tagesbedarf eines Erwachsenen an Vitamin A beträgt 1,6 mg. Mutationen im Opsin-Gen können zu einer Retinitis pigmentosa führen.
Ein ähnliches Molekül, das Bakteriorhodopsin, findet sich in Halobakterien. Es enthält ebenfalls Retinal und ist ebenfalls aus sieben Transmembrandomänen aufgebaut. Jedoch ist es nicht an ein G-Protein gekoppelt. Es dient der Photosynthese.
In höheren grünen Pflanzen fungiert hingegen Phytochrom als Lichtrezeptor, das ebenso wie Rhodopsin in verschiedenen Zuständen vorkommen kann und der Pflanze damit Auskunft über die gerade vorhandenen Lichtbedingungen gibt.
Siehe auch
Weblink
Wikimedia Foundation.