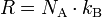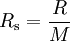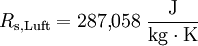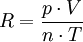- Spezifische Gaskonstante
-
Die universelle, ideale, molare oder auch allgemeine Gaskonstante (Formelzeichen: R, Rm oder Rn) ist das Produkt aus Avogadro-Konstante (NA) und Boltzmann-Konstante (kB).
Das Produkt hat den Wert 8,314472 J mol−1 K−1 mit einer geschätzten Standardabweichung von 0,000015 J mol−1 K−1 (Quelle: CODATA[1]):
spezifische Gaskonstante Rs, bzw. individuelle Gaskonstante Ri Gas SI-Einheit
[J·kg−1·K−1]Molare Masse
[g·mol−1]Argon, Ar 208 39,94 Kohlenstoffdioxid, CO2 188,9 44,01 Kohlenstoffmonoxid, CO 297 28,01 Helium, He 2077 4,003 Wasserstoff, H2 4124 2,016 Methan, CH4 518,3 16,05 Stickstoff, N2 296,8 28,02 Sauerstoff, O2 259,8 31,999 Propan, C3H8 189 44,09 Schwefeldioxid, SO2 130 64,07 trockene Luft 287 28,97 Wasserdampf, H2O 462 18,01 Die allgemeine Gaskonstante wurde auf empirischem Weg als Proportionalitätskonstante der allgemeinen Gasgleichung ermittelt und dient hier der Verknüpfung der Zustandsgrößen Temperatur, Stoffmenge, Druck und Volumen, wird jedoch auch in zahlreichen weiteren Anwendungen und Formeln genutzt. Es ist hierbei jedoch alles andere als offensichtlich, dass die molare Gaskonstante für alle idealen Gase denselben Wert hat und dass es in der Folge eine universelle bzw. allgemeine Gaskonstante gibt. Man könnte vermuten, dass der Gasdruck von der Molekülmasse des Gases abhängt, was aber für ideale Gase nicht der Fall ist. Die Feststellung, dass die molare Gaskonstante für verschiedene ideale Gase identisch ist, folgt aus dem Gesetz von Avogadro, das 1811 erstmals von Amadeo Avogadro postuliert wurde.
spezifische Gaskonstante
Die universelle Gaskonstante geteilt durch die molare Masse eines bestimmten Gases ergibt die spezifische oder auch individuelle Gaskonstante (Formelzeichen: Rs, Rspez)
Da die Molmasse in der Regel die verbreitetere Kenngröße eines Gases ist, sollte die Verwendung der spezifischen Gaskonstante vermieden und stattdessen die universelle Gaskonstante zusammen mit der Molmasse verwendet werden.
Beispiel an Luft
Die molare Masse ML für trockene Luft beträgt 28,9644 g/mol = 0,0289644 kg/mol. Somit ergibt sich für die spezifische Gaskonstante Rs, Luft von Luft
Ein Experiment zur Ermittlung einer Näherung der Gaskonstante
Hilfsmittel
Benötigte Apparaturen
- 1 Messzylinder 200 ml
- 1 Stativ + Klemme für den Messzylinder
- 1 Aquarium bzw. großer Glasbehälter gefüllt mit Wasser (bei Raumtemperatur)
- 1 Feuerzeug
- 1 Fön oder eine andere möglichst gute Trockenmöglichkeit
Benötigte Messgeräte
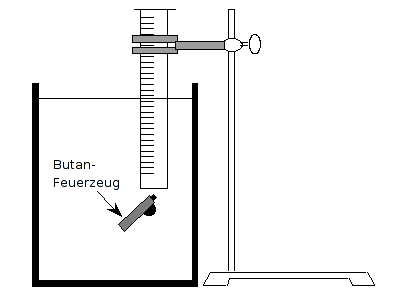
Versuchsanordnung
Arbeitsvorschrift
- Man misst die Masse des Feuerzeuges möglichst genau, idealerweise auf 10 mg oder genauer, und notiert den Wert als Masse 1.
- Man füllt den Messzylinder vollständig mit Wasser aus dem Aquarium, hält ihn oben zu und taucht ihn verkehrt herum in das Aquarium ein. Anschließend wird der Zylinder mit einem Stativ fixiert.
- Man taucht das Feuerzeug in das Aquarium und lässt von unten das Butan aus dem Feuerzeug in den Messzylinder strömen. Dabei ist darauf zu achten, dass alle Gasblasen auch wirklich in dem Zylinder aufsteigen.
- Nachdem der Zylinder zu ca. 130–150 ml befüllt ist, entfernt man das Feuerzeug und trocknet es gründlich mit einem Fön. VORSICHT! Das Feuerzeug darf dabei nicht zu heiß werden (Gefahr des Zerknallens). Anschließend erneut die Masse des Feuerzeuges bestimmen und sich den Wert als Masse 2 notieren.
- Der Messzylinder wird gelockert, und an der Stativstange solange auf- bzw. abgesenkt, bis das Niveau des Wassers im Zylinder und außerhalb gleich hoch ist. Dadurch stellt man sicher, dass der Druck innerhalb des Messzylinders der gleiche ist wie der äußere Luftdruck.
Abschließend ermittelt man folgende Werte: Raumtemperatur (Raumthermometer), Luftdruck (Barometer), exaktes Gasvolumen im Messzylinder (wenn nicht bekannt so viel Wasser einfüllen bis der Zylinder gefüllt ist; das Volumen des zugegebenen Wassers entspricht dann dem Volumen des Gases im Zylinder), Massenabnahme des Feuerzeuges (Masse 1 minus Masse 2), Sättigungsdampfdruck des Wassers (mit Hilfe der ermittelten Raumtemperatur in der Tabelle des dortigen Artikels zu finden).
Wir nehmen an, das Gas im Feuerzeug sei reines Butan (C4H10). Wir dividieren die Massenabnahme im Feuerzeug durch die Molmasse von Butan (58 g/mol). Der resultierende Wert ist die Stoffmenge Butan im Mol.
Um den wirklichen Druck zu berechnen, den das Butan im Messzylinder ausübt, subtrahiert man den Sättigungsdampfdruck von Wasser bei Raumtemperatur vom äußeren Luftdruck.
Man hat nun experimentell alle Werte ermittelt um die Gaskonstante wie folgt errechnen zu können:
Wenn man nun in diese umgeformte Form der allgemeinen Gasgleichung alle ermittelten Werte (die Temperatur in Kelvin, den Druck in Pascal, das Volumen in Kubikmeter und die Stoffmenge in Mol) einsetzen, erhalten wir mit durchaus ansehnlicher Genauigkeit einen experimentell ermittelten Wert für R.
Referenzen
- ↑ Wert der allgemeinen Gaskonstante veröffentlicht durch das amerikanische National Institute of Standards and Technology mit CODATA als Datenquelle
Siehe auch
Wikimedia Foundation.