- Sr(OH)2
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Strontiumhydroxid Andere Namen Strontianhydrat
Verhältnisformel Sr(OH)2 CAS-Nummer - 18480-07-4 (wasserfrei)
- 1311-10-0 (Octahydrat)
Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse - 121,63 g·mol−1 (wasserfrei)
- 385,70 g·mol−1 (Octahydrat)
Aggregatzustand fest
Dichte 3,63 g·cm−3 (wasserfrei) [1]
Schmelzpunkt Löslichkeit schlecht in Wasser (20 g/L bei 20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34 S: 26-27-36/37/39-45 WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Strontiumhydroxid ist das Hydroxid des Erdalkalimetalls Strontium. Die Summenformel lautet Sr(OH)2.
Inhaltsverzeichnis
Darstellung
Strontiumhydroxid kann durch die Reaktion von Strontium mit Wasser dargestellt werden. Es entsteht Strontiumhydroxid und Wasserstoff.
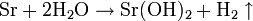
Des weiteren wird Strontiumhydroxid unter starker Wärmeentwicklung durch die Reaktion von Strontiumoxid mit Wasser gebildet.
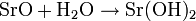
Es kann auch aus einem beliebigen Strontiumsalz (am besten dem Nitrat- oder Chloridsalz wegen ihrer hohen Löslichkeit) durch den Zusatz von Natronlauge oder Kalilauge in einer wässrigen Lösungen dargestellt werden.
Eigenschaften
Das Salz bildet farblose, durchsichtige Kristalle. In der Kristallstruktur von Strontiumhydroxid ist jedes Sr2+-Ion von sieben OH−-Ionen in einem mittleren Abstand von 2,6 Ångström umgeben.
In Wasser gelöst ist Strontiumhydroxid eine starke Base. Es nimmt in diesem Zustand Kohlenstoffdioxid (CO2) aus der Luft unter Bildung von Strontiumcarbonat auf. Strontiumhydroxid ist leichter in Wasser löslich als die Hydroxide von Calcium und Magnesium. Es ist weniger toxisch als Bariumhydroxid.
Verwendung
Strontiumhydroxid ist ein Mittel zur Regulierung des pH-Werts in Haarentfernungsmitteln. Früher wurde Strontiumhydroxid in der Zuckerindustrie zur Reinigung der Melasse verwendet.[2]
Quellen
Wikimedia Foundation.
