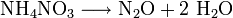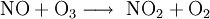- Stickoxidul
-
Strukturformel 
Allgemeines Name Distickstoffoxid (INN) Andere Namen - Lachgas
- Stickoxydul
- Azo-oxid
- E 942
Summenformel N2O CAS-Nummer 10024-97-2 PubChem 948 ATC-Code N01AX13
Kurzbeschreibung farbloses Gas mit süßlichem Geruch Arzneistoffangaben Wirkstoffklasse Eigenschaften Molare Masse 44,01 g·mol−1 Aggregatzustand gasförmig
Dichte 1,85 kg·m−3 [1]
Schmelzpunkt −91 °C [1]
Siedepunkt −88 °C [1]
Dampfdruck 51 bar [1] (20 °C)
Löslichkeit 1,2 g/l in Wasser [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Brand-
fördernd(O) R- und S-Sätze R: 8 S: 9-17 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 180 mg·m−3 [2]
GWP 298 (bezogen auf 100 Jahre) [3] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Distickstoffmonoxid ist ein farbloses Gas aus der Gruppe der Stickoxide, bekannt unter dem Trivialnamen Lachgas. Die chemische Summenformel für das Gas ist N2O. In älterer Literatur wird Distickstoffoxid auch als Stickoxydul beziehungsweise Stickoxidul bezeichnet.
Inhaltsverzeichnis
Geschichte
Das Gas wurde 1772 von Joseph Priestley entdeckt, die besonderen medizinischen Eigenschaften entdeckte der Chemiker Humphry Davy 1799 durch Selbstversuche. Der erste Zahnarzt, der Lachgas als Narkosemittel verwendete, war Horace Wells in Hartford, Connecticut. Er setzte das Gas ab dem Jahr 1844 bei Zahnextraktionen ein, nachdem er dessen schmerzstillende Wirkung zufällig bei einer Vergnügungsanwendung beobachtet hatte, wie sie damals auf Jahrmärkten üblich war.
Namensherkunft
Für die Herkunft des Namens Lachgas gibt es unterschiedliche Vermutungen. Am populärsten ist die Vermutung, dass der Name von einer Euphorie herrührt, die beim Einatmen entstehen kann, sodass der Konsument lacht. Weitere Vermutungen sind, dass sich durch Einatmung des Gases Zwerchfellkrämpfe einstellen können, die von Außenstehenden als Lachen interpretiert werden, jedoch nicht euphorischer Natur sind. Da Lachgas nach seiner Entdeckung zunächst gerne im Zirkus und auf Jahrmärkten zur Belustigung des Publikums eingesetzt wurde, könnte auch hierin der eigentliche Ursprung des Namens zu finden sein.
Herstellung
Die Herstellung erfolgt durch kontrollierte thermische Zersetzung von chloridfreiem Ammoniumnitrat NH4NO3[4] oder durch Erhitzen von einer Mischung aus Ammoniumsulfat und Natriumnitrat. Die Temperatur darf bei beiden Darstellungswegen jedoch nicht höher als 300°C steigen, da es sonst zu einem explosiven Zerfall von Ammoniumnitrat kommen kann.
Vorkommen
Lachgas wird nicht nur direkt vom Menschen freigesetzt, sondern auch indirekt durch intensive Landwirtschaft. Wenn im Boden Sauerstoffmangel herrscht, wird Stickstoffdünger in Lachgas umgewandelt.
Neuere Untersuchungen haben auch gezeigt, dass auch Maßnahmen zur Senkung der Stickoxidemissionen aus Verbrennungsprozessen zu einer zum Teil erheblichen Zunahme der Lachgasemissionen führen. Zum Beispiel findet man bei Kraftwerken mit zirkulierender Wirbelschichtfeuerung, die verfahrensbedingt geringe Stickoxidemissionen aufweisen, sehr große Lachgasemissionen. Ähnliches gilt bei Kraftfahrzeugen mit geregeltem Dreiwegekatalysator, über deren Auswirkungen auf das globale N2O-Budget noch Unsicherheit besteht. Da der Anteil der Katalysatorfahrzeuge aber weltweit weiterhin ansteigen wird, kann auch in den nächsten Jahren beim Einsatz der heutigen Dreiwegekatalysatoren mit einem deutlichen Anstieg der Kfz-bedingten N2O-Emissionen gerechnet werden.
In der chemischen Industrie ist die Adipinsäuresynthese (Polyamid-Vorprodukt) ein Lachgas freisetzender Prozess, welcher im Treibhaus-Budget der Unternehmen gelistet wird und auch ein Ziel von Reduktionsanstrengungen ist.
Eigenschaften
Lachgas ist in kaltem Wasser gut löslich: Bei 0 °C löst sich das Gas im Volumenverhältnis 1 : 1,305 in flüssigem Wasser, bei 25°C immer noch im Verhältnis 1 : 0,596[5]. Aus neutralen wässrigen Lösungen lässt sich bei tiefen Temperaturen ein kristallines Gashydrat ausschneiden, in dem auf jedes N2O-Molekül 5,75 Wassermoleküle kommen. Unter erhöhtem Druck weist Lachgas außerdem eine sehr gute Löslichkeit in Fetten auf. Lachgas ist nicht brennbar, kann aber andere Stoffe oxidieren. Daher wirkt es brandfördernd. Mit Kohle, Schwefel und Phosphor brennen in Lachgas wie in Sauerstoff. Um auch andere Stoffe zu oxidieren, benötigt es eine deutlich höhere Temperatur als bei einer Reaktion mit Sauerstoff. Da N2O eine metastabile Verbindung ist, zerfällt es bei ca. 600 °C in seine Elemente:
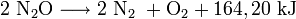 .
.
N2O ist ein Treibhausgas. Durch sein Absorptionsspektrum trägt es dazu bei, ein sonst zum Weltall hin offenes Strahlungsfenster zu schließen. Mit einer mittleren atmosphärischen Verweilzeit von 114 Jahren und einem relativ hohen molekularen Treibhauspotenzial von 298 ist es ein klimarelevantes Gas.[3] Sein Beitrag zum anthropogenen Treibhauseffekt beträgt heute etwa 5 %.
N2O trägt zum Ozonabbau bei: Die UV-induzierte Spaltung von Ozon in ein freies Sauerstoffatom und ein Molekül O2 führt in der unteren Stratosphäre zu einer Reihe von chemischen Prozessen, in denen Methan, Wasserdampf, molekularer Wasserstoff und Stickoxide oxidiert werden. Dabei gehen die Stickoxide vom N2O zunächst in Stickstoffmonoxid NO, dann Stickstoffdioxid NO2 über. Wasser geht über in die Radikale •OH (Hydroxyl-Radikal und •O2H. Für die Wasserstoffverbindungen endet hier die Oxidationskette, während sie für die Stickstoffverbindungen noch weitergehen kann zum NO3 und N2O5.
Das beim Abbau von Lachgas in der Stratosphäre zum Teil gebildete NO kann Ozon abbauen:
Ein Teil des NO2 kann durch Reaktion mit Sauerstoffatomen NO zurück bilden so dass in der Summe die Ozonabbaureaktion katalysiert wird
Lachgas ist als Lebensmittelzusatzstoff unter der Bezeichnung E 942 als Treibgas, beispielsweise für Schlagsahne, zugelassen.
Thermodynamik
Physiologie
Das Gas riecht leicht süßlich. Beim Einatmen wirkt es stark schmerzstillend und schwach narkotisch. Analgetische (schmerzstillende) Effekte treten ab einer Konzentration von etwa 20 Prozent Distickstoffoxid in der Atemluft auf. Es können Halluzinationen oder Farbveränderungen auftreten. Es reagiert im Körper im Prinzip nicht, wahrscheinlich oxidiert es aber das Vitamin B12. Die Wirkung von Lachgas ist nur kurz, bereits nach ungefähr fünfzehn Minuten sind keine Wirkungen mehr wahrnehmbar. Lachgaskonsum führt bei vielen Menschen zu einer verstärkten Wahrnehmung akustischer Reize.
Verwendung
- In der Medizin wird Lachgas als analgetisch (gegen den Schmerz) wirkendes Gas zu Narkosezwecken benutzt. Es ist das älteste und ein relativ nebenwirkungsarmes Narkosemittel. Unter Anwendung von N2O kann es zur Störung der Wirkung von Vitamin B12 und Folsäure kommen und damit zu den Folgen einer perniziösen Anämie. Um eine wirkungsvolle Konzentration von 70 % zu erreichen, muss es zusammen mit reinem Sauerstoff gegeben werden. In der modernen Anästhesie wird die Wirkung des Lachgases durch Zugabe anderer Narkosemittel optimiert. Vorteilhaft ist, dass das Gas in der Narkose rasch an- und abflutet. Problematisch kann die Diffusion von Lachgas in luftgefüllte Körperhohlräume werden. Der medizinische Gebrauch von Lachgas als Narkosemittel ist in den letzten Jahren rückläufig.
- In der Zahnmedizin ist Lachgas seit Jahrzehnten ein bewährtes Sedierungsmittel (Beruhigungsmittel), das vor allem bei Kindern und ängstlichen Patienten, aber auch bei starkem Würgereiz Anwendung findet. Nebenwirkungen sind bei korrekter Verabreichung selten.
- In der Nahrungsmitteltechnik wird Lachgas aufgrund seiner sterilisierenden Wirkung als Treibgas benutzt, vorzugsweise für Milchprodukte, z. B. zum Aufschäumen (statt Schlagen) von Schlagsahne.
- In der Drogenszene findet Lachgas wegen seiner halluzinogenen Wirkung und der leichten Verfügbarkeit (Druckgaskapseln für Schlagsahne) Verwendung. Das Gas wird in der Regel mittels eines sogenannten Kapslers in Luftballons abgefüllt und aus diesen konsumiert. Der Rausch dauert etwa 30 Sekunden bis 3 Minuten an, unter anderem kann es zu einer Veränderung der Geräuschwahrnehmung (etwa starkes Echo), einem Kribbeln in den Gliedmaßen und traumartigen Halluzinationen kommen. Entgegen landläufiger Meinung ruft der Konsum von Lachgas zu Rauschzwecken kein Lachen hervor. Bei häufigem Konsum besteht wahrscheinlich die Gefahr von Nervenschäden infolge Vitamin-B12-Mangels.
- In der Antriebstechnik, etwa bei PKW, wird Distickstoffmonoxid zur Steigerung der Motorleistung von Ottomotoren verwendet, da es mehr Sauerstoff enthält als Luft. Diese sogenannte Lachgaseinspritzung erfordert nur relativ geringe konstruktive Änderungen am Motor und kann seine Leistung kurzfristig um etwa 20 bis 50 % steigern. Das Distickstoffmonoxid wird dabei aus Druckbehältern in den Ansaugtrakt geblasen. Dieses Tuning ist vor allem in den USA verbreitet, seine Verwendung im öffentlichen Straßenverkehr ist aber sowohl dort als auch in Deutschland verboten und den meisten anderen Ländern nur eingeschränkt erlaubt. Die bekanntesten Hersteller von Lachgaseinspritzungen sind NOS, NX und Venom.
- In der Raketentechnik wird Lachgas, etwa in Hybridraketen wie dem SpaceShipOne, als Oxidator eingesetzt. Der Vorteil liegt darin, dass es sich ohne Kühlung durch Druck verflüssigen lässt. Daher benötigt man für den Einsatz in solchen Triebwerken nur ein Drosselventil, jedoch keine Kraftstoffpumpe oder aufwendige Kryotechnik.
- In der Katalyseforschung wird Lachgas bei der reaktiven Frontalchromatographie angewendet, um die katalytisch wirksame Kupferoberfläche zu bestimmen.
Gefahren
Bei der Verwendung von großen Gasflaschen in engen, geschlossenen Räumen besteht geringe Erstickungsgefahr. Lachgas ist brandfördernd (Vergleiche: Glimmspanprobe). Daher dürfen bei Verwendung von Lachgas keine offenen Flammen vorhanden sein. Besondere Gefahren beim Missbrauch als Droge: Falls Lachgas direkt aus Kapseln oder Gasflaschen eingeatmet wird, kann es zu Erfrierungserscheinungen an Lippen, Kehlkopf und Bronchien kommen, da aufgrund der Entspannung des unter Druck stehenden Gases eine Abkühlung stattfindet (Joule-Thomson-Effekt). Es besteht eine erhöhte Verletzungsgefahr durch Stürze beim „Wegtreten“. Weitere unangenehme Nebenwirkungen sind leichte Übelkeit und Kopfschmerzen. Bei exzessivem und unsachgemäßen Konsum kann es zudem zu Bewusstlosigkeit und Herzrhythmusstörungen kommen. Schlimmstenfalls droht Tod durch Atemlähmung. Zudem können Lachgaskapseln mit Kohlenstoffdioxid-Kapseln (CO2) verwechselt werden. Bei einer solchen Verwechslung besteht akute Erstickungsgefahr. Um nicht dem Erstickungstod zu erliegen, muss ständige Sauerstoffzufuhr gewährleistet sein.
Rettungsmaßnahmen
Wichtigste Maßnahme ist Frischluftzufuhr. Da das Gas schnell wieder aus dem Körper gelangt, finden Notärzte meist keine akuten Vergiftungserscheinungen vor. Die Patienten sind mit Sauerstoff zu beatmen.
Quellen
- ↑ a b c d e f Sicherheitsdatenblatt (praxair)
- ↑ Eintrag zu CAS-Nr. 10024-97-2 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2008 (JavaScript erforderlich)
- ↑ a b P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 212, (PDF)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 484-5.
- ↑ Holleman-Wiberg, 101. Aufl. 1995, S. 689f
Weblinks
- Lachgas bei Erowid (englisch)
- Eve&Rave (Schweiz) Lachgas: Substanzinformationen sowie „Böse Pillen“-Listen
Wikimedia Foundation.