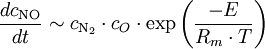- Stickoxyd
-
Stickoxide, Nitrose Gase oder Stickstoffoxide sind Sammelbezeichnungen für die gasförmigen Oxide des Stickstoffs. Sie werden auch mit NOx abgekürzt, da es auf Grund der vielen Oxidationsstufen des Stickstoffs mehrere Stickstoff-Sauerstoff-Verbindungen gibt. Manchmal wird die Abkürzung NOx auch für die so genannten Nitrosen Gase (siehe unten) verwendet.
Wertigkeit von N Summenformel Bezeichnung +1 N2O Distickstoffmonoxid (Lachgas) +2 NO Stickstoffmonoxid +3 N2O3 Distickstofftrioxid +4 NO2 Stickstoffdioxid +4 N2O4 Distickstofftetroxid +5 N2O5 Distickstoffpentoxid Die Stickstoffoxide sind ausnahmslos endotherme Verbindungen, das heißt sie bilden sich aus den Elementen nur unter äußerem Zwang (Energiezufuhr). Dies bedingt andererseits ihre technische Verwendbarkeit als Oxidationsmittel (zum Beispiel Distickstofftetroxid in der Raketentechnik, oder Lachgas für heiße Flammen). Mit Ausnahme des Lachgases verhalten sie sich gegenüber Wasser (beispielsweise in der Atmosphäre) als Säurebildner. Unter anderem wegen dieser Säurebildung (auf den Schleimhäuten) wirken sie reizend und giftig. Damit zogen sie (mit Ausnahme des Lachgases) schon frühzeitig eine umweltpolitische Aufmerksamkeit auf sich. Lachgas hat einerseits medizinische und technische Anwendungen, andererseits wird es bei technischen und landwirtschaftlichen Prozessen unbeabsichtigt in die Atmosphäre abgegeben. Dort wirkt es als Treibhausgas und Ozonkiller. Näheres unter Lachgas.
Stickstoffmonoxid tritt im menschlichen Körper als Botenstoff auf und findet in der Behandlung unter anderem von Angina Pectoris Anwendung.
Distickstofftrioxid ist in kondensierter Form (-21 °C) tiefblau und in fester Form (-102 °C) blassblau gefärbt. Bei Temperaturen oberhalb 0 °C zerfällt die Verbindung in Stickstoffmonoxid und Stickstoffdioxid. Aufgrund dieser Eigenschaft kann man den Siedepunkt nicht feststellen.
Inhaltsverzeichnis
Nitrose Gase
Nitrose Gase ist die Trivialbezeichnung für das Gemisch aus Stickstoffmonoxid (NO) und Stickstoffdioxid (NO2). Nitrose Gase entstehen unter anderem bei der Reaktion von Salpetersäure (HNO3) mit organischen Stoffen oder Metallen. (Bei der Reaktion von Salpetersäure mit Silber und Kupfer entsteht sehr viel NOx). Eine weitere Ursache für Stickoxide sind Abgase, die bei der Verbrennung fossiler Brennstoffe, wie beispielsweise Kohle oder Öl, entstehen.
Die typisch rotbraunen Dämpfe der nitrosen Gase werden im Wesentlichen durch das Stickstoffdioxid (NO2) hervorgerufen. Nitrose Gase haben einen charakteristischen stechenden Geruch und können mit Verzögerung von mehr als 24 Stunden (Latenzzeit) nach dem Einatmen noch zu einem Lungenödem führen. Bei Männern kann zudem Impotenz bei häufigerem Einatmen als Spätfolge eintreten.
Auswirkungen von Stickoxiden
- Reizung und Schädigung der Atmungsorgane (insbesondere Stickstoffdioxid)
- Entstehung des Sauren Regens: Bildung von Salpetersäure (HNO3) durch Reaktion von (2 NO2 + H2O → HNO3 + HNO2) oder durch Aufnahme von N2O5 in Aerosolpartikel und nachfolgender Bildung von NO3- in der flüssigen Phase.
- Smogbildung
- Ozonbildung unter Einfluss von UV-Strahlung
NOx in der Feuerung
Stickoxide werden in der Regel entsprechend ihrer Quellen und ihres Bildungsmechanismus in 3 Arten unterteilt:
- thermisches NOx
- Brennstoff- oder fuel-NOx
- promptes NOx
Die in diesem Zusammenhang erwähnte „NOx“ setzen sich in der Feuerung zu etwa 95 % NO und 5 % NO2 zusammen. Mit Hilfe der Reaktionskinetik lässt sich die Änderung der Konzentrationen des NOx beschreiben. Hierbei sind letztlich die Konzentrationen von N2 und O als auch die Temperatur maßgebliche Einflussfaktoren:
Der Exponentialterm ist der Ansatz über die Arrhenius-Gleichung, cN2 und cO die Konzentrationen zu Beginn der Reaktion.
Thermisches NOx
Die Bezeichnung „thermisch“ bezieht sich auf die relativ hohen Temperaturen, die zur Initiierung der Bildungsreaktion des thermischen NOx über N2 benötigt werden. Die Stickstoffquelle des thermischen NOx ist der in der Verbrennungsluft vorhandene Stickstoff, der zur Oxidation des N2 nötige Sauerstoff entstammt ebenfalls der Verbrennungsluft. Zeldovich beschreibt die Entstehung in zwei beziehungsweise drei Schritten, das Schema ist als einfacher beziehungsweise erweiterter „Zeldovich-Mechanismus“ bekannt.
Startreaktion ist die Umsetzung von Luftstickstoff mit atomarem Sauerstoff, in der Stickstoffradikale entstehen. Diese oxidieren in der zweiten Reaktion weiter:
- (1)
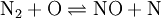
- (2)
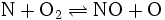
Der dritte Schritt berücksichtigt, dass die bei der Verbrennung entstehenden Hydroxid-Radikale (OH) ebenfalls mit Stickstoff reagieren können:
- (3)
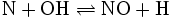
Mit der Bildung von thermischem NOx ist bei Verbrennungstemperaturen ab etwa 1 250 °C zu rechnen, die Bildungsrate nimmt mit der Temperatur exponentiell zu. Unterhalb dominiert bei stickstoffhaltigen Brennstoffen das so genannten „Brennstoff-NOx“ oder „fuel-NOx“. Ebenso haben der angebotene Sauerstoff und die Verweilzeit der Reaktionspartner in der Verbrennungszone einen Einfluss auf die NOx-Entstehungsrate. Untersuchungen zur Stickoxidbildung am Lichtbogenofen belegen, dass neben den technischen Verbrennungsprozessen fossiler Brennstoffe wie Erdöl oder Erdgas auch O2/N2-Plasmen gute Bildungsbedingungen für Stickoxide aufweisen.
Brennstoff-NOx
Quelle dieser NOx-Art sind die im Brennstoff gebundenen Anteile an Stickstoff, die während der Verbrennung in NOx umgesetzt werden. Die mitgeführte Menge an Stickstoff ist stark brennstoffabhängig, dementsprechend variieren auch die durch die Verbrennung entstehenden Anteile von thermischem und Brennstoff-NOx im Rauchgas.
Einige Beispiele sind (Anteile in %):
-
Brennstoff therm. NOx BS-NOx aus
flüchtigen BestandteilenBS-NOx
aus KoksPrompt-NOx Diesel/Benzin
Innermotorisch90-95 - - 5-10 Gas 100 - - - Schweröl 40-60 60-40 - - Steinkohle
Trockenfeuerung10-30 50-70 20-30 - Steinkohle
Schmelzfeuerung40-60 30-40 10-20 - Braunkohle <10 >80 <10 -
Man unterscheidet bei festen Brennstoffen zwei Arten der Stickstofffreisetzung. Die homogene Freisetzung beschreibt die Ausgasung des im Brennstoff gebundenen Stickstoffs mit den flüchtigen Bestandteilen während die Heterogene den Abbrand des Restkoks beschreibt.
Wesentliche Quelle für Brennstoff-NOx sind die flüchtigen Bestandteile des Brennstoffes.
Brennstoff-NOx entsteht ab Temperaturen um etwa 800 °C vorwiegend in den Flammenfronten der Feuerungsanlagen. Hierbei durchläuft der mitgeführte Brennstoff mehrere Reaktionsschritte, die über Blausäure (HCN) und Hydrazin (NHn) zu NO und N2 führen. N2 und NO können mit Kohlenwasserstoff-Radikalen (CHn) eine Rückreaktion zu HCN durchlaufen („Reburning“) und hierbei wieder zu NO oder aber zu molekularem Stickstoff (N2) umsetzen. Dadurch erhöht sich in der Summe die Menge an molekularem Stickstoff. Diesen Effekt macht man sich in der so genannten „Brennstoff-Stufung“, einer primären Schadstoff-Minderungsmaßnahme, zu Nutze.
Promptes NOx
Statt der Umsetzung zu N2 kann die Reaktion der Brennstoffradikale (CHn) mit N2 wieder zur Bildung von NOx führen. Diesen Anteil an entstandenem NOx bezeichnet man als „promptes“ NOx und ist auch als „Fenimore-Mechanismus“ bekannt.
Wesentlicher Einflussfaktor sind die entstehenden Kohlenwasserstoff-Radikale, die als Zwischenprodukte der Verbrennung kohlenstoffhaltiger fossiler Brennstoffe vorliegen. Deren Bildungsmechanismen sind äußerst komplex und bisher noch nicht vollständig erfasst und verstanden. Promptes NOx entsteht in sehr schnellen Bildungsreaktionen in vergleichbar geringen Mengen und ist im Vergleich zum thermischen NOx kaum temperaturabhängig, wenngleich der Anteil mit steigender Temperatur zunimmt.
NOx-Minderung
In den Kraftwerken gibt es verschiedene Möglichkeiten der NOx-Minderung.
Die Primärmaßnahmen betreffen den Feuerungsprozess und verhindern die Entstehung:
- Luftstufung
- Brennstoffstufung
- interne Abgasrückführung
- externe Abgasrückführung
- Primäradditivierung
- Quenchen (Eindüsung von Wasser zur Temperatur-Minderung)
Die Sekundärmaßnahmen mindern das NOx im Abgas (Rauchgasentstickung):
Auch für die Abgase von Kraftfahrzeugen kommen Maßnahmen zur Minderung zum Einsatz.
Gemeinsames Merkmal der Reduktionsmaßnahmen ist, dass sie keine komplette Problementsorgung bedeuten. Eine solche wäre gegeben, wenn als Produkt der Entgiftungsreaktion Stickstoff (als natürlicher Atmosphärenbestandteil) auftreten würde. Stattdessen führen die verfügbaren Verfahren häufig zu Lachgas. Näheres siehe dort.
Literatur
Bücher
- Helmut Effenberger: Dampferzeugung. Springer-Verlag, ISBN 3-540-64175-0.
- J. Warnatz, U. Maas, R. W. Dibble: Verbrennung. 3. Auflage, Springer-Verlag, ISBN 3-540-42128-9.
- G.P. Merker, G. Stiesch: Technische Verbrennung Motorische Verbrennung. B.G. Teubner Verlag, Stuttgart, ISBN 3-519-06381-6.
Aufsätze
- Erich Fitzer, Dieter Siegel: Stickoxid-Emissionen industrieller Feuerungsanlagen in Abhängigkeit von den Betriebsbedingungen. In: Chemie Ingenieur Technik. Nr. 47(13), 1975 ISSN 0009-286X, S. 571.
- Rainer Römer, Wolfgang Leckel, Alfred Stöckel, Gerd Hemmer: Beeinflussung der Stickoxid-Bildung aus brennstoffgebundenem Stickstoff durch feuerungstechnische Maßnahmen. In: Chemie Ingenieur Technik. Nr. 53(2), 1981, ISSN 0009-286X, S. 128 - 129.
- Heinrich Wilhelm Gudenau, Klaus E. Herforth: Stickoxid-Bildung bei der Umsetzung fester Brennstoffe in verschiedenen Gasmedien. In: Chemie Ingenieur Technik. Nr. 53(9), 1981, ISSN 0009-286X, S. 742 – 743.
- Manfred Schrod, Joachim Semel, Rudolf Steiner: Verfahren zur Minderung von NOx-Emissionen in Rauchgasen. In: Chemie Ingenieur Technik. Nr. 57(9), 1985, ISSN 0009-286X, S. 717 – 727.
- Hans-Georg Schäfer, Fred N. Riedel: Über die Bildung von Stickoxiden in Großfeuerungsanlagen, deren Einfluß auf die Umwelt, ihre Verminderung sowie ihre Entfernung aus den Abgasen der Kraftwerke. In: Chemiker-Zeitung. Nr. 113(2), 1989, ISSN 0009-2894, S. 65 - 72.
- Ulrich Förstermann: Stickoxid (NO): Umweltgift und körpereigener Botenstoff. In: Biologie in unserer Zeit. Nr. 24(2), 1994, ISSN 0045-205X, S. 62 – 69.
Siehe auch
Weblinks
Wikimedia Foundation.