- Sucrose
-
Strukturformel 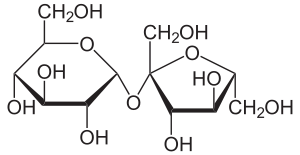
Kristallsystem monoklin-sphenoidisch Allgemeines Name Saccharose Andere Namen - Sucrose
- 2-β-D-Fructofuranosyl- 1-α-D-Glucopyranosid
- Kristallzucker
- Rohrzucker
- Rübenzucker
- Haushaltszucker
Summenformel C12H22O11 CAS-Nummer 57-50-1 Kurzbeschreibung farbloser kristalliner Feststoff mit süßem Geschmack Eigenschaften Molare Masse 342,30 g·mol−1 Aggregatzustand fest
Dichte 1,5737 g·cm−3 (30 °C) [1]
Schmelzpunkt Löslichkeit sehr leicht löslich in Wasser: 1970 g in 1 l Wasser (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Saccharose (ausgesprochen Sackarose oder Sacharose), auch Sucrose genannt, ist der Haushalts- oder Kristallzucker, der gemeinhin als „der Zucker“ gilt. Sowohl die Zuckerrübe als auch das Zuckerrohr enthalten dieses Disaccharid. Die Konstitution wurde von Haworth (1883−1950) aufgeklärt.[2]
Inhaltsverzeichnis
Chemische Eigenschaften
Die Saccharose gehört wie andere Zuckerarten zu den Kohlenhydraten. Sie ist ein Disaccharid (Zweifachzucker). Saccharose besteht als Dimer aus je einem Molekül α-D-Glucose (Pyranoseform) und β-D-Fructose (Furanoseform). Diese beiden Moleküle sind über eine α,β-1,2-glycosidische Bindung miteinander verbunden (Glucose α1-2 Fructose) , die sich unter Austritt eines Wasser-Moleküls (Kondensationsreaktion) über die OH-Gruppen der anomeren C-Atome miteinander gebildet hat.
Saccharose ist ein nicht reduzierendes Disaccharid. Nicht reduzierende Disaccharide sind über ihre beiden anomeren C-Atome O-glycosidisch miteinander verknüpft, ihre chemische Bezeichnung endet mit -sid. Dies bedeutet, dass im Saccharose-Molekül die beiden Komponenten so miteinander verbunden vorliegen, dass keine Aldehydgruppe unter Ringöffnung (weder vom Glucose- noch vom Fructose-Molekül) gebildet werden kann. Diese nicht reduzierenden Atomgruppierungen nennt man Acetale. Acetale sind im Gegensatz zu Halbacetalen vergleichsweise stabil in basischem und neutralem Milieu. Sie sind nur durch Säurekatalyse zu öffnen, wobei das Disaccharid z. T. in Monosaccharide gespalten wird, es entsteht Invertzucker (stoffmengengleiche Teile Glucose und Fructose). Saccharose zeigt aufgrund der in neutralem Milieu unterbleibenden Ringöffnung fast keine Mutarotation.
Physikalische Eigenschaften
Erhitzung und Verbrennung
Beim Erhitzen von Saccharose auf 185 °C schmilzt sie und bildet unter Zersetzung eine braun werdende Schmelze (Karamell). Wird die Saccharose verbrannt, entstehen Zuckerkohle und ein übelriechendes Gas.
Wasserlöslichkeit
Saccharose ist in Wasser sehr gut löslich. Die Löslichkeit ist, wie bei den meisten Feststoffen, temperaturabhängig:
max. Löslichkeit reiner Saccharose Temperatur in °C g Saccharose / g Wasser 20 1,97 50 2,59 55 2,73 60 2,89 65 3,06 70 3,25 75 3,46 80 3,69 85 3,94 90 4,20 100 4,87 [1] Bei 20°C erhält man eine 66%ige Lösung (Dichte 1,33 kg/L), bei 100°C dagegen eine 84%ige gesättigte Lösung (Dichte 1,44 kg/L), die beim Abkühlen jedoch keine Kristalle mehr ausscheidet („gehinderte Kristallisation“).
Drehung von polarisiertem Licht
In wässriger Lösung dreht Saccharose polarisiertes Licht im Uhrzeigersinn (+65°). Durch Auflösung von Saccharose entsteht ein Gemisch (Invertzucker), das halb aus Glucose und halb aus Fructose besteht. Diese Mischung dreht polarisiertes Licht gegen Uhrzeigersinn (-20°), man beobachtet also eine Umkehrung der Drehungsrichtung (Inversion).
Süßkraft
Die Süßkraft ist eine dimensionslose Größe, welche die relative Süßheit eines Stoffes angibt. Die Werte der Süßkraft beziehen sich dabei auf Saccharose, welcher eine Süßkraft von 1 zugeordnet wird.[3] Die Süßkraft dient einem halbquantitativen Vergleich insbesondere für Süßungsmittel wie z. B. Aspartam (Süßkraft ca. 180). Süßungsmittel können eine mehrere hundert- oder tausendfache Süßkraft aufweisen und werden somit nur in geringen Mengen zum Süßen verwendet.
Gewinnung
Saccharose wird von vielen Pflanzen mittels Photosynthese gebildet, für die Gewinnung des Haushaltszuckers sind vor allem Zuckerrüben und Zuckerrohr von Bedeutung. In kleinerem Maße wird Saccharose auch aus dem Saft des Zuckerahorns gewonnen.
Geschichte
Der sakcharon der antiken Welt (von Sanskrit: carkara, zerbrechlich, steinartig) war ursprünglich der Tabaschier (Bambusstein), dem heilende Kräfte zugeschrieben wurden. Erst später übertrugen die Araber das Wort auf den ähnlich aussehenden Rohrzucker. Nach Lippmann wurde Rohrzucker auch in Indien erst im dritten bis sechsten Jahrhundert bekannt.[4]
Quellen
- ↑ a b c d e Eintrag zu Saccharose in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 21. Okt. 2007 (JavaScript erforderlich)
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 1221
- ↑ Question No. 215 : How sweetness can be measured? Is there a simple method to measure sweetness of sugar and other type of sweeteners? Singapore Science Center, 20006
- ↑ Edmund O. von Lippmann: Geschichte des Zuckers. seit d. ä̈ltesten Zeiten bis zum Beginn d. Rübenzucker-Fabrikation.. Springer, Berlin 1929.
Siehe auch
Wikimedia Foundation.
