- Bakteriochlorophyll
-
 Blätter einer Magnolie.
Blätter einer Magnolie.Das Chlorophyll (von griechisch χλωρός, chlōrós – hellgrün, frisch und φύλλον, phýllon – Blatt) oder Blattgrün bezeichnet eine Klasse natürlicher Farbstoffe, die von Organismen gebildet werden, die Photosynthese betreiben. Insbesondere Pflanzen erlangen ihre grüne Farbe durch Chlorophyllmoleküle.
Pflanzen, Algen und Cyanobakterien besitzen verschiedene Chlorophylltypen, photosynthesetreibende Bakterien verschiedene Typen von Bacteriochlorophyll.
Inhaltsverzeichnis
Struktur und Eigenschaften
Chlorophylle sind Chelat-Komplexe, bestehend aus einem derivatisierten Porphyrin-Ring und Mg2+ als Zentralion. Im Gegensatz zum Porphyrin enthält das Grundgerüst der Chlorophylle einen weiteren, fünften Ring an Ring III (Nummerierung nach Fischer). Je nach Art des Chlorophylls sind an den Grundkörper verschiedene Seitenketten angehängt.
Strukturell sind die Chlorophylle mit den Hämen verwandt, welche als Bestandteil des Blutfarbstoffs (Hämoglobin), des Myoglobins und der Cytochrome auftreten, als Zentralion jedoch nicht Magnesium sondern Eisen enthalten.
Chlorophylle sind gut löslich in Ethanol und Aceton, sowie ähnlichen Lösungsmitteln.
Läuft die Photosynthese bei Lebewesen ab, die Sauerstoff freisetzen (oxygene Phototrophe), spricht man allgemein von Chlorophyll. Anoxygene Phototrophe erzeugen jedoch nicht Sauerstoff als Reaktionssprodukt bei der Photosynthese, bei diesen Organismen bezeichnet man das Chlorophyll als Bakteriochlorophyll.
Chemische Struktur bei oxygenen Phototrophen
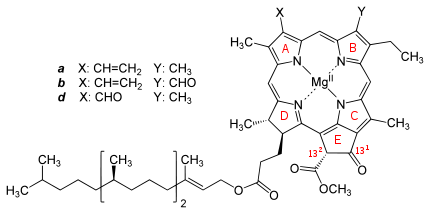
Name Struktur C3-Rest C7-Rest C8-Rest C17-Rest C17-18-Bindung Summenformel Chlorophyll a 
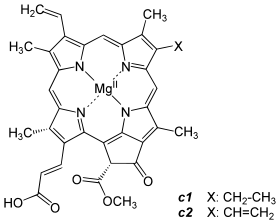
-CH=CH2 -CH3 -CH2CH3 -CH2CH2COO-Phytyl Einfachbindung C55H72O5N4Mg Chlorophyll b -CH=CH2 -CHO -CH2CH3 -CH2CH2COO-Phytyl Einfachbindung C55H70O6N4Mg Chlorophyll c1 -CH=CH2 -CH3 -CH2CH3 -CH=CHCOOH Doppelbindung C35H30O5N4Mg Chlorophyll c2 -CH=CH2 -CH3 -CH=CH2 -CH=CHCOOH Doppelbindung C35H28O5N4Mg Chlorophyll d -CHO -CH3 -CH2CH3 -CH2CH2COO-Phytyl Einfachbindung C54H70O6N4Mg Chemische Struktur bei anoxygenen Phototrophen: Bakteriochlorophylle (Bchl)
a: Keine Doppelbindung zwischen C7 und C8 (farblich markiert im Bild)
b: Bei Bchl c, d und e handelt es sich um ein Gemisch von Isomeren, bei denen der Rest R3 bzw. R4 unterschiedlich substituiert ist.Spektrale Eigenschaften
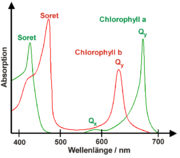
Die Absorptionsspektren von in Lösungsmitteln gelösten Chlorophyllen besitzen immer zwei ausgeprägte Absorptionsmaxima, eines zwischen 600 und 800 nm, das als Qy-Bande bezeichnet wird, und eines um 400 nm, das Soret-Bande genannt wird. Die Abbildung rechts zeigt diese Absorptionsmaxima für Chlorophyll a und b. Zusätzlich existiert die Qx-Bande um 580 nm, die senkrecht zu Qy polarisiert ist und in der Regel sehr schwach absorbiert. Für Chlorophyll a ist sie in der Abbildung noch zu erkennen, für Chlorophyll b verschwindet sie im Untergrund.
Anhand der Spektren in der Abbildung kann man leicht verstehen, warum Blätter – diese enthalten Chlorophyll a und b – grün sind. Zusammen absorbieren Chlorophyll a und b hauptsächlich im blauen Spektralbereich (400–500 nm) sowie im roten Spektralbereich (600–700 nm). Im grünen Bereich hingegen findet keine Absorption statt, so dass grünes Licht gestreut wird, was Blätter grün erscheinen lässt.
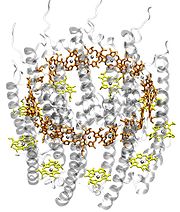 Struktur des Antennenkomplex LH2 eines Purpurbakteriums. Die BChl sind gelb (B800) und orange (B850) gezeichnet. Zur besseren Übersichtlichkeit wurden die Phytylschwänze nicht gezeichnet und die Proteinumgebung transparent dargestellt. Die Magnesiumatome im Zentrum der BChl sind als Kugeln dargestellt.
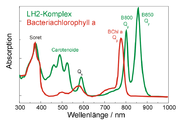
Struktur des Antennenkomplex LH2 eines Purpurbakteriums. Die BChl sind gelb (B800) und orange (B850) gezeichnet. Zur besseren Übersichtlichkeit wurden die Phytylschwänze nicht gezeichnet und die Proteinumgebung transparent dargestellt. Die Magnesiumatome im Zentrum der BChl sind als Kugeln dargestellt.Die Absorption ist abhängig vom Lösungsmittel und dementsprechend kann die Lage der Absorptionsmaxima je nach Art des Lösungsmittels um einige wenige Nanometer variieren. In der natürlichen Umgebung von Chlorophyllen, also der Proteinumgebung, sieht das anders aus. Hier hängt die Lage der Absorptionsmaxima von zwei Faktoren ab: (1) Je nach Partialladung der umgebenden Aminosäuren und Verbiegung der Seitengruppen der Chlorophyllmoleküle können die Absorptionsmaxima bei stark unterschiedlichen Wellenlängen liegen. (2) In Proteinen kommen sich Chlorophylle sehr nahe, sodass sie eine Wechselwirkung aufeinander ausüben (Dipol-Dipol-Wechselwirkung; bei sehr geringen Abständen auch Austauschwechselwirkung). Diese Wechselwirkung führt zu einer Absenkung der Energieniveaus und damit zu einer Rotverschiebung der Absorptionsmaxima. Dies kann man besonders eindrucksvoll am Beispiel des Antennenkomplexes LH2 von Purpurbakterien sehen. Der LH2-Komplex besteht aus zwei ringförmig angeordneten Gruppen von Bacteriochlorophyllmolekülen (siehe Abbildung links). Der obere Ring (B850) enthält 18 BChl a-Moleküle, die in sehr geringen Abständen voneinander liegen, also stark gekoppelt sind. Der untere Ring (B800) besteht aus 9 BChl a-Molekülen, die deutlich weiter voneinander entfernt liegen und somit viel schwächer gekoppelt sind.
Durch die starke Kopplung wird die Absorption von BChl a im B850-Ring zu Rot verschoben. Die Absorptionsbande liegt bei 850 nm. Die schwachgekoppelten BChl a des B800-Rings absorbieren hingegen bei 800 nm, also ungefähr im gleichen Bereich wie in Lösungsmittel gelöste BChl a-Moleküle. Im Absorptionsspektrum (Abbildung rechts) des LH2-Komplexes sind die Absorptionsbanden der B800- und der B850-BChl-a-Moleküle deutlich getrennt. Zusätzlich werden Banden dargestellt, die von Carotinoidmolekülen stammen, diese sind in der Struktur nicht eingezeichnet.
Typen
Es gibt verschiedene Typen von Chlorophyll, die sich in den Seitengruppen des Porphyrins unterscheiden. Sie besitzen verschiedene Absorptionsspektren und kommen bei verschiedenen phototrophen Organismen vor:
Chlorophylltyp Farbe Absorptionsmaxima
(in nm)[1]Vorkommen Chlorophyll a blaugrün 430, 662 Cyanobakterien und alle phototrophen Eukaryoten Chlorophyll b gelbgrün 454, 643 Grünalgen (Chlorophyta), Euglenozoa und alle Landpflanzen Chlorophyll c grün 444, 576, 626 an Stelle von Chlorophyll b bei Braunalgen (Phaeophyta), Kieselalgen (Bacillariophyta),
Goldalgen (Chrysophyta), Gelbgrüne Algen (Xanthophyta) , Haptophyta, Dinophyta und RaphidophyceaeChlorophyll d 447, 688 an Stelle von Chlorophyll b bei Rotalgen (Rhodophyta) Bacteriochlorophyll a grün 358, 577, 773 Purpurbakterien[2] (Rhodospirillaceae, Chromatiaceae) Bacteriochlorophyll b 368, 580, 794 Schwefelpurpurbakterien (Chromatiaceae); Purpurbakterien[2] Bacteriochlorophyll c grün 432, 660 Grüne Schwefelbakterien[2] (Chlorobiaceae) Bacteriochlorophyll cs 740[2] Grüne Nichtschwefelbakterien[2] (Chloroflexaceae) Bacteriochlorophyll d 458, 646 Grüne Schwefelbakterien[2] (Chlorobiaceae) Bacteriochlorophyll e 424, 654 Grüne Schwefelbakterien[2] (Chlorobiaceae) Bacteriochlorophyll g 408, 418, 470, 575, 763 Heliobacteria[2] Biosynthese
Chlorophyll wird bei Eukaryoten in den Chloroplasten synthetisiert, bei Prokaryoten im Cytoplasma. Bei vielen Phototrophen wird die Chlorophyll-Bildung durch Licht induziert und bleibt ohne Belichtung aus. Die Biosynthese besteht aus einer Reihe zahlreicher Schritte mit einer entsprechenden Anzahl spezifischer Enzyme.[3]
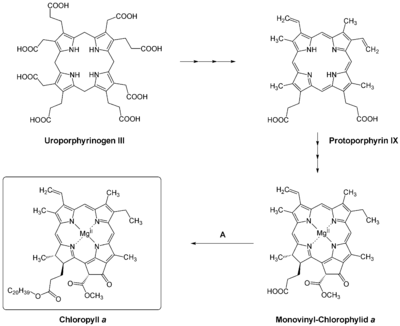
Die Synthese dieses und anderer Tetrapyrrole ist ein mehrstufiger Prozess, der auch verschiedene Verzweigungspunkte aufweist. Die Biosynthese geht von L-Glutamat aus und endet in einem Sirohäm-, einem Häm- und einem Chlorophyll-Zweig.
Nach mehreren Schritten wird aus L-Glutamat Uroporphyrinogen III gebildet, dem ersten Verzweigungspunkt, aus dem Sirohäm gebildet werden kann. Uroporphyrinogen III wird dann in drei Schritten zu Protoporphyrin IX umgesetzt, was den zweiten Verzweigungspunkt zu den Hämen darstellt. In Protoporphyrin IX wird bei einer ATP-abhängigen Reaktion das Magensiumion eingeführt, was eine Magesium-Chelatase (EC 6.6.1.1) katalysiert. Das hierbei gebildete Mg-Protoporphyrin IX wird über Mg-Protoporphyrin IX-Monoethylester zu Dinvinyl-Protochlorophyllid a umgesetzt. Jenen Schritt katalysiert eine Cyklase, die den fünften Ring in Chlorophyll einführt. In Pflanzen ist dieses Enzym O2-abhängig, während es bei Prokaryonten sowohl O2-abhängige als auch -unabhängige Cyclasen gibt.
In nächsten Schritt wird der D-Ring des Protochloropylls durch eine Oxidoreduktase (EC 1.3.1.33) zu Divinyl-Chlorophylid a reduziert. In Angiospermen ist diese Reaktion absolut lichtabhängig. Daher bilden Keimlinge erst dann Chlorophyll, wenn sie dem Licht ausgesetzt sind.[4] Andere Pflanzen (einige Gymnospermen), Algen aber auch Cyanobakterien haben sowohl eine lichtabhängige als auch lichtunabhängige Oxidoreduktase. Infolgedessen können diese Organismen Chlorophyll auch im Dunkeln synthetisieren. Divinyl-Chlorophylid a wird durch eine Reduktase zu Monovinyl-Chlorophylid a reduziert, bevor dieses in einem letzten Schritt mittels Phytolphosphat zu Chlorophyll a verestert wird. Diesen terminalen Schritt katalysiert eine Chlorophyll-Synthase, eine Prenyltransferase (EC 2.5.1.62).
Aus Chlorophyll a kann auch Chlorophyll b bzw. umgekehrt gebildet werden.
Bedeutung in der Photosynthese
Chlorophylle haben innerhalb der Photosynthese mehrere Aufgaben. Der mit Abstand größte Anteil dient der Lichtabsorption und der Weiterleitung der absorbierten Energie. Hierzu sind die Chlorophyllmoleküle in Lichtsammelkomplexen organisiert, die so angeordnet sind, dass einerseits eine möglichst große absorbierende Fläche gebildet wird und andererseits ein energetischer Trichter entsteht, der die absorbierte Energie zum sogenannten Reaktionszentrum leitet. Im Reaktionszentrum dienen zwei Chlorophylle als Akzeptor dieser Energie. Sie sind so speziell angeordnet, dass ihre Anregung zu einer Ladungstrennung führt, die als erster Schritt der eigentlichen Photosynthese betrachtet werden kann. Dieses Chlorophyllpaar wird im englischen als special pair bezeichnet.
Bei den sehr verschiedenen photosynthesebetreibenden Organismen gibt es vielfältige Unterschiede in der Struktur der Lichtsammelkomplexe, das Reaktionszentrum hingegen ist immer nahezu gleich strukturiert. Das special pair wird bei Pflanzen, Algen und Cyanobakterien immer von Chlorophyll a, bei Bakterien von verschiedenen Bakteriochlorophyllen gebildet.
Geschichte
Erste Studien über die chemische Struktur des Chlorophylls stammen von Richard Willstätter. Der Chemiker Hans Fischer nahm Willstätters Forschungen in den 1930ern wieder auf, 1940 konnte er die Struktur des Moleküls aufklären. Fischers Forschungsergebnisse wurden 1960 durch Robert B. Woodwards Chlorophyllsynthese bestätigt.
Sonstiges
Eine wichtige Eigenschaft des Chlorophylls ist die Chlorophyll-Fluoreszenz. Sie wird vor allem zum Bestimmen des Chlorophyllgehalts und dessen Aktivität sowie für andere wissenschaftliche Analysen genutzt.
Wegen seiner geruchsneutralisierenden Wirkung ist Chlorophyll auch in Drageeform in der Apotheke erhältlich, als Mittel gegen Mund- und Körpergeruch.
Als Lebensmittelzusatzstoff erhält Chlorophyll die Kennnummer E 140.
Siehe auch
Einzelnachweise
- ↑ Hugo Scheer (Editor): Chlorophylls. CRC Press, 1991. ISBN 0-8493-6842-1
- ↑ a b c d e f g h Michael T. Madigan (Autor), John M. Martinko (Autor), Thomas Lazar (Übersetzer), Freya Thomm-Reitz (Übersetzer): Brock - Mikrobiologie. Pearson Studium; 11., aktualisierte Auflage 2009; ISBN 978-3-8273-7358-8; S. 607
- ↑ Samuel I. Beale: Enzymes of chlorophyll biosynthesis (Review). In: Photosynthesis Research. Bd. 60, 1999. S. 43–73. Hier auch Darstellung des Biosynthese-Wegs
- ↑ Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie; a. a. O.; S. 292
Literatur
- Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. Spektrum Akademischer Verlag GmbH, 4. Auflage 2008; ISBN 978-3-8274-1961-3
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Elsevier Spektrum Akademischer Verlag GmbH, Heidelberg 2007, ISBN 978-3-8274-1800-5
- Tanaka, R. und Tanaka, A. (2007): Tetrapyrrole biosynthesis in higher plants. In: Annu Rev Plant Biol. 58; 321–346; PMID 17227226; doi:10.1146/annurev.arplant.57.032905.105448
Weblinks
- Stoffwechselweg für die Bildung von Chlorophyll und Häm bei KEGG-Enzyme
- Absorptionsspektren der Oregon University of Health & Sciences
Wikimedia Foundation.