- Säure-Base-Reaktion
-
Säure-Base-Reaktionen sind chemische Reaktionen, bei denen Wasserstoff-Kationen H+ (Protonen) zwischen Molekülen oder Molekül-Ionen übertragen werden. Weil bei diesem Reaktionstyp ein Teilchen ein Proton „ablöst“, das von einem anderen Teilchen aufgenommen wird, nennt man diese Reaktion auch Protolyse. Nach Brønsted wird das Teilchen, das das Proton abgibt, als Brønsted-Säure oder Protonendonator bezeichnet. Das Teilchen, welches das Proton empfängt, heißt Brønsted-Base oder Protonenakzeptor.
Stellt man eine Brønsted-Säure durch das Symbol HA dar und eine Brønsted-Base durch B, so lässt sich eine Säure-Base-Reaktion nach Brønsted wie folgt formulieren:

Säure + Base steht im Gleichgewicht zur konjungierten (korrespondierten) Base + konjungierten (korrespondierten) Säure Inhaltsverzeichnis
Protolyse
Säure-Base-Reaktionen lassen sich in zwei Teilreaktionen zerlegen, die beide als Protolyse bezeichnet werden:
- Protonenabgabe:

- Protonenaufnahme:

Beim Auflösen von Chlorwasserstoffgas in Wasser entsteht Salzsäure. Hierbei dient der Ampholyt Wasser als Base.
In diesem Beispiel gibt HCl ein H+ ab und wird damit zu Cl−. Das freie H+ wird von H2O aufgenommen, das damit zu H3O+ wird.
Im anderen Fall: Ammoniak reagiert mit dem Ampholyt Wasser, das jetzt als Säure fungiert, zu einer basischen Lösung.
Neutralisation
Einen Sonderfall der Säure-Base-Reaktion stellt die Neutralisation dar, bei der eine saure Lösung mit einer basischen Lösung zu einer neutralen Lösung reagiert. Die eigentliche neutralisierende Reaktion besteht darin, dass Oxonium(Hydronium)ionen der Säure als Protonendonatoren mit Hydroxidionen der Base als Protonenakzeptoren zu neutralem Wasser reagieren:

Weiteres Beispiel: Chlorwasserstoffgas reagiert mit Ammoniakgas zu festem Ammoniumchlorid (Salmiak).

Titration
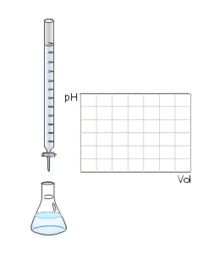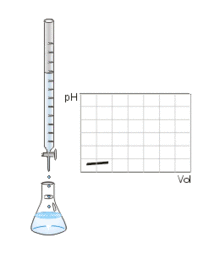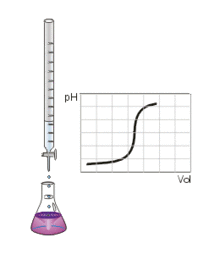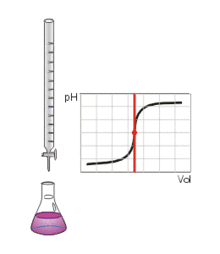
Bei einer Säure-Base-Titration wird eine abgemessene saure oder basische Probelösung aus einer Bürette mit einer Maßlösung bekannter Konzentration versetzt, um die unbekannte Konzentration der Probelösung zu bestimmen. Ein sprunghafter Anstieg der Titrationskurve oder ein Farbumschlag des Indikators zeigt das Erreichen des Äquivalenz- bzw. Endpunktes der Titration an.
Weblinks
-
 Wikibooks: Anorganische Chemie für Schüler/ Säure - Basen - Reaktionen – Lern- und Lehrmaterialien
Wikibooks: Anorganische Chemie für Schüler/ Säure - Basen - Reaktionen – Lern- und Lehrmaterialien -
 Wikibooks: Allgemeine und Anorganische Chemie/ Säure-Base-Reaktionen – Lern- und Lehrmaterialien
Wikibooks: Allgemeine und Anorganische Chemie/ Säure-Base-Reaktionen – Lern- und Lehrmaterialien
Kategorien:- Acidität und Basizität
- Chemische Reaktion
- Protonenabgabe:
Wikimedia Foundation.