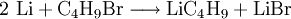- T-Butyllithium
-
Strukturformel 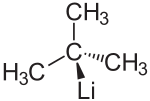
Allgemeines Name tert-Butyllithium Andere Namen - t-Butyllithium
- t-BuLi
Summenformel C4H9Li CAS-Nummer 594-19-4 Kurzbeschreibung Äußerst pyrophore Substanz, in der Regel als Lösung in Pentan Eigenschaften Molare Masse 64,05 g·mol−1 Aggregatzustand Als Lösung in Pentan
Dichte 0,66 g·cm−3[1]
Schmelzpunkt 36–40 °C[1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] bezogen auf 1,5 M Lösung in n-Hexan



Ätzend Hoch-
entzündlichUmwelt-
gefährlich(C) (F+) (N) R- und S-Sätze R: 12-14/15-34-51/53-65-66-67 S: 9-16-26-29-33-36/37/39-43-45-61-62 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. tert-Butyllithium (t-BuLi) ist eine tertiäre metallorganische Verbindung des Elements Lithium. Daneben gibt es noch die isomeren Formen n-Butyllithium und sec-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. t-BuLi ist somit die stärkste Base in dieser Reihe. t-BuLi zerfällt bei Raumtemperatur in Lithiumhydrid und Isobuten. Das entstandene Isobuten wird durch weiteres t-BuLi in der Allylstellung deprotoniert, was zu einer weiteren Konzentrationserniedrigung des t-BuLi führt.
Inhaltsverzeichnis
Vorkommen
Kein natürliches Vorkommen, da t-BuLi ausschließlich synthetisch hergestellt wird.
Gewinnung und Darstellung
Die Synthese kann durch Reaktion von t-Butylbromid mit Lithium (Pulver) erfolgen.
Eigenschaften
Physikalische Eigenschaften
t-BuLi ist auch in Lösung äußerst pyrophor und verbrennt an der Luft mit einer typisch roten Flamme. Im Handel ist es als Lösung in Pentan oder Heptan erhältlich, wobei eine Konzentration von 1,7 mol/L üblich ist. Ether wie THF oder Diethylether sind als Lösemittel für t-BuLi ungeeignet, da sie rasch zersetzt würden.
Chemische Eigenschaften
Reaktionen
Die Lithium-Kohlenstoff-Bindung im Tert-Butyllithiummolekül ist stark polarisiert (man misst den Grad dieser Polarisierung auch in „% Ionencharakter“). Das Kohlenstoffatom trägt dabei eine negative und das Lithiumatom eine positive Partialladung. tert-Butyllithium verhält sich daher chemisch ähnlich wie ein entsprechendes Carbanion. Durch Formulierung einer mesomeren Grenzstruktur lässt sich dieses Verhalten veranschaulichen:[2]
Ähnlich wie n-Butyllithium kann auch t-BuLi für den Lithium-Halogenaustausch und zum Deprotonieren von Aminen und aktivierten C-H-Verbindungen verwendet werden. t-BuLi kann zudem die Alpha-Position der Ether angreifen.Dies zeigt das Beispiel Tetrahydrofuran, welcher bereits bei Raumtemperatur innerhalb von Minuten zersetzt wird:
Diese Methode wird zum Beispiel benutzt, wenn deprotonierter Acetaldehyd benötigt wird.
Verwendung
t-BuLi hat in der modernen synthetischen organischen Chemie Bedeutung als ultrastarke Base bzw. als Lithiierungsreagenz erlangt. Da es einiges pyrophorer als n-BuLi ist, wird es weniger oft eingesetzt. In einigen Fällen wird es wegen der höheren Basizität oder aus sterischen Gründen (der t-Butylrest ist räumlich relativ groß) verwendet.
Sicherheitshinweise
Wie bereits erwähnt, ist t-BuLi auch in Lösung äußerst pyrophor. Die Handhabung und Lagerung sollte daher stets unter Schutzgas stattfinden. t-BuLi reagiert zudem heftig mit Wasser zu Lithiumhydroxid und Isobutan. Bei längerer Lagerung bildet sich zudem ein Bodensatz aus Lithiumhydrid (Selbstzersetzung) und Lithiumhydroxid (eingedrungene Feuchtigkeit).
Quellen
- ↑ a b c Sicherheitsdatenblatt (alfa-aesar) t-Butyllithium (1,5 mol·l−1) in n-Pentan
- ↑ K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 3. Auflage. Wiley-VCH, 2005, ISBN 978-3527298198
Wikimedia Foundation.