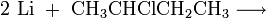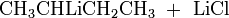- Sec-Butyllithium
-
Strukturformel 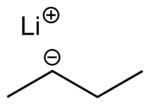
Allgemeines Name sec-Butyllithium Andere Namen - s-Butyllithium
- s-BuLi
Summenformel C4H9Li CAS-Nummer 598-30-1 Kurzbeschreibung Selbstenzündlich an der Luft; In der Regel Lösung in Cyclohexan Eigenschaften Molare Masse 64,05 g·mol−1 Aggregatzustand Lösung in Cyclohexan
Dichte 0,769 g·cm−3[1]
Löslichkeit - löslich in Cyclohexan
- reagiert heftig mit Wasser.
Sicherheitshinweise Gefahrstoffkennzeichnung [1] bezogen auf 1,4 M Lösung in Cyclohexan



Ätzend Leicht-
entzündlichUmwelt-
gefährlich(C) (F) (N) R- und S-Sätze R: 11-15-17-34-65-67-50/53 S: 26-36/37/39-43-45-60-61-62 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. sec-Butyllithium (s-BuLi) ist eine sekundäre metallorganische Verbindung des Elements Lithium. Daneben gibt es noch die isomeren Formen n-Butyllithium und tert-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. s-BuLi ist somit die zweitstärkste Base in dieser Reihe. sec-Butyllithium ist kommerziell üblicherweise als Lösung in Cyclohexan erhältlich. Während der Lagerung kann sich ein feiner Lithiumhydrid-Niederschlag bilden; Dies führt auch zu Konzentrationserniedrigung der Lösungen.
Inhaltsverzeichnis
Vorkommen
Kein natürliches Vorkommen, da s-BuLi ausschließlich synthetisch hergestellt wird und zudem über eine sehr hohe Reaktivität verfügt.
Gewinnung und Darstellung
Die Synthese kann z. B. durch Reaktion von 2-Chlorbutan mit elementarem Lithium erfolgen.[2]
Eigenschaften
Physikalische Eigenschaften
s-BuLi ist pyrophor und verbrennt an der Luft mit einer typisch roten Flamme.
Chemische Eigenschaften
Reaktionen
s-BuLi kann für den Lithium-Halogenaustausch oder zum Deprotonieren, beispielsweise von Aminen oder Alkoholen, verwendet werden. Mit Kupfer(I)-iodid werden Lithiumdi-sec-butylcuprate gebildet. Im Vergleich zu n-BuLi reagiert s-BuLi bei Raumtemperatur schneller mit Diethylether und THF.
Verwendung
Die Kohlenstoff-Lithium-Bindung ist stark polarisiert, was dazu führt, dass der Kohlenstoff sehr nucleophil und basisch ist. s-Buli ist basischer als n-Buli und zusätzlich sterisch mehr gehindert. Diese beiden Eigenschaften kann man sich in diversen Synthesen zu Nutze machen. Es wird z. B. eingesetzt, wenn nur eine schwache C-H-Acidität vorliegt und n-BuLi keine zufriedenstellende Resultate liefert.
Sicherheitshinweise
s-BuLi ist an der Luft selbstentzündlich und reagiert zudem heftig mit Wasser. Das Reagenz sollte daher immer unter Schutzgas (z. B. Argon) gelagert und gehandhabt werden.
Quellen
- ↑ a b Produkteseite (Sigma-Aldrich) s-Butyllithium (1,4 mol·l−1) in Cyclohexan
- ↑ H. Gilman, F. W. Moore, and O. Baine: Secondary and Tertiary Alkyllithium Compounds and Some Interconversion Reactions with Them, in: J. Am. Chem. Soc. 1941, 63, 2479–2482.
Literatur
- Autorenkollektiv: Organikum. 21. Auflage. Wiley-VCH Weinheim, 2001, ISBN 3-527-29985-8
- Christoph Elschenbroich: Organometallchemie. 5. Auflage, Teubner Wiesbaden 2005, ISBN 3-519-53501-7.
Wikimedia Foundation.