- Taupunktkurve
-
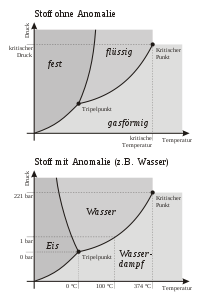
Unter einer Phasengrenzlinie versteht man die Gesamtheit der Zustandsgrößen, welche den Zustand eines Stoffes oder Stoffgemisches während eines Phasenübergangs bzw. an der Phasengrenze als Grenzfläche eindeutig beschreiben. Sie setzt sich daher aus Punkten (Zuständen) des jeweiligen Phasendiagramms (Stoffes) zusammen, wobei in dem durch diese Punkte beschriebenen Zustand ein thermodynamisches Gleichgewicht zwischen zwei oder mehr Phasen des Stoffes bzw. Stoffgemisches besteht.
Teile und wichtige Begrenzungspunkte der Phasengrenzlinien sind markante Zustände innerhalb des Phasendiagramms wie der Tripelpunkt, der kritische Punkt oder der eutektische Punkt. Den Bereich zwischen den Phasengrenzlinien, an welchen nur eine einzige Phase vorliegt, bezeichnet man als Zustandsraum.
Einzelne Phasenlinien mit ihren gebräuchlichsten Synonymen und die zugehörigen Phasenumwandlungen sind:
Feststoff oder Flüssigkeit → Gas (Sammelbegriff):
- Dampfdruckkurve (siehe Sättigungsdampfdruck); Synonyme: Sättigungsdampfdruckkurve, Dampfdrucklinie, Sättigungsdampfdrucklinie
- Sammelbegriff für die Zustandsübergänge Verdampfen/Kondensation und Sublimierung/Resublimation bei Reinstoffen.
Flüssigkeit → Gas:
- Siedekurve; Synonyme: Siedelinie, Siedepunktskurve, Siededruckkurve und Siedepunktkurve
- Bezeichnung des Phasenübergangs: Verdampfen (auch Sieden)
- Bezeichnung der Zustände während des Phasenübergangs: Siedepunkte/Siedebereich
Gas → Flüssigkeit:
- Kondensationskurve; Synonyme: Kondensationslinie, (für Wasser auch Taulinie, Taukurve, Taupunktkurve, Taupunktlinie)
- Bezeichnung des Phasenübergangs: Kondensation
- Bezeichnung der Zustände während des Phasenübergangs: Kondensationspunkt/Kondensationsbereich
Feststoff → Flüssigkeit:
- Schmelzkurve; Synonyme: Schmelzlinie, Schmelzpunktskurve, Schmelzdruckkurve, Schmelzpunktskurve
- Bezeichnung des Phasenübergangs: Schmelzen
- Bezeichnung der Zustände während des Phasenübergangs: Schmelzpunkt/Schmelzbereich
Flüssigkeit → Feststoff:
- Erstarrungskurve; Synonyme: Erstarrungslinie, Gefrierpunktskurve, Gefrierpunktslinie
- Bezeichnung des Phasenübergangs: Gefrieren
- Bezeichnung der Zustände während des Phasenübergangs: Gefrierpunkt/Gefrierbereich
Feststoff → Gas:
- Sublimationskurve; Synonyme: Sublimationslinie
- Bezeichnung des Phasenübergangs: Sublimierung
- Bezeichnung der Zustände während des Phasenübergangs: Sublimationspunkt/Sublimationsbereich
Gas → Feststoff:
- Resublimationskurve
- Bezeichnung des Phasenübergangs: Resublimieren
- Bezeichnung der Zustände während des Phasenübergangs: Resublimationspunkt/Resublimationsbereich
Hierbei gilt, dass die Linien bei Reinstoffen identisch mit den Linien der entgegengesetzten Phasenübergänge sind. Bei mehreren Stoffen muss dies jedoch nicht der Fall sein, da sich zwischen den Phasengrenzlinien Mischungslücken ausbilden können (siehe Siedediagramm oben rechts). Man muss daher in diesen Fällen auch nach der Richtung des Phasenübergangs differenzieren. Zu beachten ist auch, dass eine weit höhere Bandbreite an Phasenübergängen existiert als nur in Form eines Wechsels zwischen verschiedenen Aggregatzuständen. Dies gilt insbesondere für Feststoffe, wobei hier wiederum Eis die meisten sogenannten Modifikationen aufweist.
Wikimedia Foundation.