- Destillateur
-
Die Destillation (lat. destillare „herabtröpfeln“) ist ein thermisches Trennverfahren, um ein flüssiges Gemisch verschiedener, ineinander löslicher Stoffe zu trennen. Die Voraussetzung für die Anwendung des Verfahrens ist die unterschiedliche Zusammensetzung der Flüssigkeit und des Dampfes. Eine, jedoch nicht ausreichende, Bedingung hierfür sind unterschiedliche Siedepunkte der zu trennenden Komponenten. Typische Anwendungen der Destillation sind das Brennen von Alkohol und das Destillieren von Erdöl in der Raffinerie.
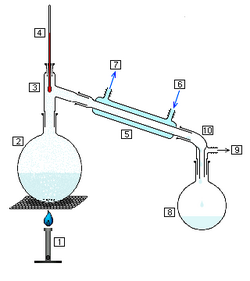
Bei der Destillation wird zunächst das Ausgangsgemisch zum Sieden gebracht. Der entstehende Dampf, der sich aus den verschiedenen Komponenten der zu trennenden Lösung zusammensetzt, wird in einem Kondensator (z. B. Liebigkühler im Labormaßstab) kondensiert. Im Anschluss wird das flüssige Kondensat aufgefangen. Die Trennwirkung beruht auf der unterschiedlichen Zusammensetzung der siedenden Flüssigkeit und des gasförmigen Dampfes.
Feste Stoffe werden durch sog. trockene Destillation (Pyrolyse) in kleinere Molekülgruppen zerlegt (zu Gasen und Flüssigkeiten).
Inhaltsverzeichnis
Geschichte
Die Destillation von Pech und Teer zur Abdichtung von Schiffen, als Klebe- und auch Heilmittel, ist seit der Jungsteinzeit bekannt und mit einfachsten Mitteln zu bewerkstelligen.
In der Antike wurden vor allem ätherische Öle, als Riech- und Duftstoffe, destilliert. Die ältesten bei archäologischen Ausgrabungen aufgefundenen Darstellungen von Destilliergeräten stammen aus Mesopotamien, dem heutigen Irak und werden auf ein Alter von über 5.500 Jahren geschätzt. Diese ersten Geräte bestanden aus einem Gefäß mit einem Deckel, an dem sich beim Erhitzen das Destillat niederschlug. Damit diese Flüssigkeit nicht wieder ins Gefäß zurücktropfte, verwendete man im Deckel Schwämme oder Wollbüschel, um die Flüssigkeit aufzusaugen. Diese wurden dann einfach regelmäßig ausgepresst, um das Destillat zu erhalten.
Mit derselben Methode erzeugten griechische Seefahrer um 500 vor Christus Trinkwasser aus Meerwasser. Aristoteles beschrieb unter anderem im 4. Jahrhundert vor Christus, wie Meerwasser durch Destillation trinkbar gemacht werden kann. Er beschrieb weiter, dass Weine und andere Flüssigkeiten demselben Verfahren unterzogen werden können.
Die Destillation wurde von dem persischen Chemiker Abu Musa Dschābir ibn Hayyān um 800 n. Chr. weiter verbessert. Auch der iranische Wissenschaftler und Arzt Ar-Razi („Rhases“, 865 - 925) schrieb seine Kenntnisse in einer Reihe umfangreicher Schriften nieder. Sein wichtigstes Werk ist das Kitab sirr al-asrar, das „Buch des Geheimnisses der Geheimnisse“. Hier beschreibt er die Destillation des naft, des rohen Erdöls, und erläutert hierbei eine einfache Art des Krackverfahrens zum Zwecke der Gewinnung niedrig siedender Produkte wie Bitumen und des sogenannten Ziegelöles (oleum laterinum). Mit der Erfindung des Destillierhelms wurde auch die Destillation von Alkohol möglich.
Als um die Jahrtausendwende (1000 n. Chr.) die Schwefel- und Salpetersäure und vor allem der Trinkalkohol (Ethanol) entdeckt wurden, gewann die Destillation erheblich an Bedeutung. Im 17. Jahrhundert kamen an wichtigen Anwendungen die Süßwasserdestillation aus Meerwasser hinzu.
Prinzipien
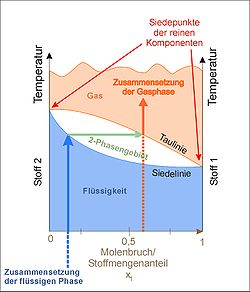
Die Destillation ist ein thermisches Trennverfahren, das gegenüber anderen den Vorteil hat, dass in der Regel keine weiteren Stoffe wie Adsorbentien oder Lösungsmittel hinzugefügt werden. Das Verfahren beruht auf den unterschiedlich hohen Siedepunkten der beteiligten Flüssigkeiten, genauer gesagt auf ihrem unterschiedlichen Dampfdruck bei gleicher Temperatur. Wird, wie in nebenstehender Abbildung zu sehen, eine Mischung aus den Stoffen 1 und 2 erhitzt, so steigt die Temperatur bis zum Erreichen der Siedekurve an. Die Zusammensetzung der Gasphase über der siedenden Flüssigkeit ist diejenige, welche die Taupunktkurve bei der gleichen Temperatur anzeigt (waagrechte Linie). Durch Kondensation erhält man eine Flüssigkeit, deren Zusammensetzung der der Gasphase entspricht, also einen erhöhten Anteil der niedriger siedenden Komponente 1 enthält (senkrechte Linie). Tatsächlich ist der Gehalt durch unvollständige Gleichgewichtseinstellung geringer. Außerdem verarmt der Destillationssumpf mit der Zeit an der niedrigsiedenden Komponente, wodurch die waagrechte Linie nach oben rutscht.
Mehrstufige Destillation und Rektifikation
Durch mehrfache erneute Destillation des Kondensates gelangt man im Siedediagramm auf einer Zickzacklinie immer näher an die Reinsubstanz 1 heran. In der Praxis erreicht man durch den Einbau einer sog. Kolonne zwischen Sumpf und Kopf schon durch einmalige Destillation eine deutlich erhöhte Trennleistung. Die Anzahl der für die gleiche Trennleistung benötigten Einzeldestillationen wird als "theoretische Bodenzahl", so genannt nach dem Verfahren der Erdöldestillation (s.u.), dieser Kolonne bezeichnet. An der Oberfläche der Kolonne stellt sich durch Kondensation und Verdampfung das Gleichgewicht zwischen flüssiger und Gasphase ständig neu ein, wodurch nach oben hin der Anteil des niedrigsiedenden Bestandteils immer weiter ansteigt, während die höhersiedende Komponente in den Sumpf zurückfließt. Die Größe der Oberfläche der Kolonne, die im einfachsten Fall aus einem langen Glasrohr besteht, wird in verschiedene Varianten wie der Vigreux-Kolonne oder durch die Füllung mit sog. Raschig-Ringen stark erhöht.
Falls die zu trennenden Stoffe ein Azeotrop bilden, so treffen sich Siede- und Taupunktkurve nicht erst bei den Reinsubstanzen. Eine destillative Trennung ist dann nur bis zu diesem Punkt möglich. Allerdings ist das azeotrope Mischungsverhältnis druckabhängig, so dass durch eine Vakuum- oder Überdruckdestillation evtl. doch eine weitere Trennung möglich ist. Das bekannteste Azeotrop dürfte Ethanol / Wasser im Verhältnis ca. 25 : 1 (bei Umgebungsbedingungen) darstellen.
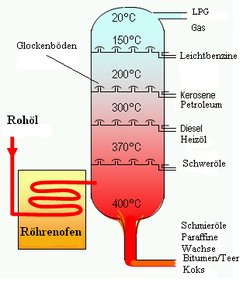
Die großtechnische Umsetzung der wiederholten, kontinuierlichen Destillation bezeichnet man auch als Rektifikation. Die einzelnen Destillationstufen finden in einem speziellen Behälter, Rektifikationskolonnen genannt, statt. Die Kolonne besteht aus mehreren Lagen von Böden, durch die der Dampf in den Kopf steigen und das Kondensat in den Sumpf fließen kann. Dabei können kontinuierlich Produkte abgezogen und Edukt nachgefüllt werden.
Fraktionierte Destillation
Ein aus mehreren Komponenten bestehendes Gemisch kann durch fraktionierte Destillation getrennt werden. Dabei wird der zum Auffangen des Destillates genutzte Behälter nach dem Abtrennen der am niedrigsten siedenden Fraktion ausgewechselt. Der Zeitpunkt zum Wechseln wird dabei durch eine Änderung der Temperatur im Destillationskopf angezeigt. Meist wird noch bis zum Erreichen des Siedepunkts der nächsten Komponente eine Zwischenfraktion abgetrennt, da im Übergangsbereich häufig ein Gemisch übergeht, und um Reste der vorherigen Fraktion aus dem Kühler zu entfernen. Liegen die Siedepunkte nahe beieinander, kann durch Zwischenschalten einer Kolonne das Volumen der unsauberen Zwischenfraktion klein gehalten werden.
Hinweis: Die Begriffe "fraktionierte Destillation" und "Rektifikation" ("Gegenstromdestillation", "Rückflussdestillation", "Kolonnendestillation") werden häufig synonym gebraucht [1]. Im strengen Sinne bedeutet "fraktionieren" jedoch lediglich das Auffangen mehrerer Fraktionen.
Vakuumdestillation
Die Vakuumdestillation ist eine Destillation bei einem niedrigeren Gesamtdruck in der Destillationsanlage. Dadurch wird die Siedetemperatur des zu trennenden Gemisches verringert, was die Destillation von Stoffgemischen ermöglicht, deren Komponenten, besonders die im Sumpf verbleibenden, nicht ausreichend temperaturstabil sind. In der Laborpraxis wird beinahe immer am Vakuum destilliert, da bei höheren Temperaturen im Sumpf, der u.A. übriges Edukt, Katalysatorrückstände oder Nebenprodukte enthalten kann, unerwünschte Reaktionen auftreten können, die die Ausbeute senken.
Großtechnisch wird das Sumpfprodukt der atmosphärischen Destillation bei der Erdölraffination einer Vakuumdestillation unterworfen, unter anderem um niedrigsiedende Rückstände zu entfernen und in die atmosphärische Destillation zurückzuführen.
Schleppdestillation
Bekannteste Variante dieser Destillationsart ist die Wasserdampfdestillation. Sie wird angewandt, um wärmeempfindliche Substanzen mit geringem Dampfdruck zu destillieren, wenn eine Vakuumdestillation nicht praktikabel erscheint, beispielsweise zur Extraktion von ätherischen Ölen aus Pflanzen, oder zur Reinigung substituierter Aromaten.
Azeotrope Destillation
Hierbei wird eine Komponente zugegeben, die mit dem abzutrennenden Stoff ein Azeotrop bildet. Beispielsweise kann bei einer sauer katalysierten Veresterung das entstehende Wasser als Azeotrop mit Toluol quantitativ entfernt werden, wodurch die Reaktion erst vollständig abläuft. Idealerweise bildet sich ein Heteroazeotrop, das beim Kondensieren in zwei Phasen zerfällt, was eine Rückführung des Lösungsmittels erlaubt.
Kurzwegdestillation
Als Kurzwegdestillation (KWD) bezeichnet man eine Destillation, die im Feinvakuumbereich, d. h. im Druckbereich zwischen 1 und 0,001 mbar durchgeführt wird. Sie gehört zu den schonendsten thermischen Trennverfahren. Aufgrund des geringen Arbeitsdrucks erfolgt die Destillation schon bei relativ niedrigen Temperaturen. Im Vergleich zu anderen Destillationsverfahren können somit thermisch empfindliche Produkte wie z. B. Tocopherole, Fettsäureester, Monoglyceride, Prepolymere, Epoxidharze u.v.m. sehr schonend getrennt werden. Ebenso können schwer verdampfbare Moleküle, wie z. B. sehr langkettige Kohlenwasserstoffe aus den Rückständen der Mineralölindustrie unter Feinvakuum abdestilliert werden. Eine modifizierte Variante ist die Kugelrohrdestillation.
Reaktivdestillation
Bei der Reaktivdestillation wird die (mehrstufige) Destillation mit einer chemischen Reaktion kombiniert. Durch die Kombination beider Mechanismen können Vorteile im Vergleich zu einfachen, seriellen Reaktions-Destillations-Verfahren erzielt werden. Reaktivdestillation eignet sich vor allem für gleichgewichtslimitierte Reaktionen, weil sich durch die ständige Entfernung eines Reaktionspartners das Gleichgewicht immer wieder neu einstellt und auf diese Weise ein vollständiger Umsatz möglich ist. Umgekehrt können durch die Reaktion auftretende Azeotrope gebrochen werden. Ferner kann die bei exothermen Reaktion die auftretende Wärme zur Stofftrennung ausgenutzt werden. Problematisch kann jedoch die Kombination der optimalen Betriebsbedingungen (vor allem der optimale Temperaturbereich für Reaktion und Stofftrennung) sein.
Die auftretende chemische Reaktion kann sowohl homogen als auch heterogen katalysiert werden. Bei der Verwendung eines homogenen Katalysators ist eine weitere Trennstufe zur Abtrennung des Katalysators notwendig. Bei der heterogen katalysierten Reaktivdestillation wird der Katalysator häufig in Form von reaktiven Packungen in der Destillationskolonne eingebaut. Dabei handelt es sich oftmals um Trennpackungen, in die der meist kugelförmige Katalysator in Metallsäckchen integriert ist. Trotz intensiver Forschungen in den letzten Jahrzehnten findet die Reaktivdestillation in der Industrie nur relativ selten Verwendung. Wichtig ist sie allerdings bei der Kaliumproduktion.
Rückflusskochen
Das Rückflusskochen ermöglicht sehr langes Kochen bei ständiger Wiedergewinnung des verdampfenden Lösungsmittels durch Kondensation. Das Rückflusskochen ist kein Trennverfahren im engeren Sinne, weil die Trennung nur vorübergehend ist. Eine erweiterte Art des Rückflusskochens wird unter Verwendung des Soxhlet-Aufsatzes durchgeführt.
Überdruckdestillation
Bei der Überdruckdestillation liegt ein großer Überdruck auf der Anlage, wodurch sich die Siedepunkte auseinander verschieben. Der Anwendungsbereich liegt bei Stoffen mit sehr niedrigen Siedepunkten die eng beieinander liegen.
Einzelnachweis
Weblinks
- www.zoll.de Technik der Branntweinherstellung
Wikimedia Foundation.