- Tertiäres Amin
-
Als Amine bezeichnet man organische Abkömmlinge (Derivate) des Ammoniaks (NH3), bei dem ein oder mehrere Wasserstoffatome durch Alkyl- oder Arylgruppen ersetzt sind.
Inhaltsverzeichnis
Systematik der Amine
Man teilt die Amine, je nachdem wie viele Wasserstoff-Atome des Ammoniaks gegen organische Molekülgruppen ausgetauscht wurden, in folgende Gruppen ein:
Amine Typen Funktionelle Gruppe Beispiel primäre Amine R-NH2 primäre Aminogruppe -NH2 Methylamin 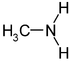
sekundäre Amine R-NH-R sekundäre Aminogruppe -NHR Dimethylamin 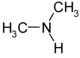
tertiäre Amine NR3 tertiäre Aminogruppe -NR2 Trimethylamin 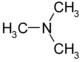
quartäre Ammoniumverbindungen NR4+ (X−) quartäre Aminogruppe -NR3+ Betain 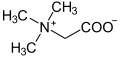
Weitere Beispiele siehe Kategorie:Amin und Kategorie:Quartäre Ammoniumverbindung Die Alkylgruppen sekundärer oder tertiärer Amine können zu einem Ring geschlossen sein. Es liegen dann cyclische sekundäre oder tertiäre Amine vor, wie z. B. Piperidin.
Eigenschaften
Chemische Eigenschaften
Wie auch Ammoniak reagieren Amine basisch, indem ein Proton an das freie Elektronenpaar des Stickstoffs angelagert wird:
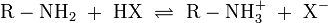
- Protonierung eines primären Amins durch eine Säure HX
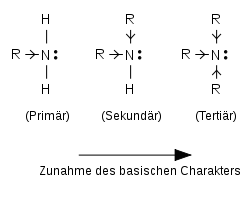
Der Substitutionsgrad von Aminen beeinflusst deren Basizität. Alkylgruppen konzentrieren die Elektronendichte auf den Stickstoffatom, so dass das freie Elektronenpaar leichter mit einer Säure geteilt werden kann. Bei reinen (wasserfreien) Aminen nimmt daher die Basizität mit zunehmendem Substitutionsgrad zu:
In Gegenwart von Wasser wird das Amin protoniert, wobei Wärme freigesetzt wird. Diese Hydratisierungswärme ist bei primären Aminen am größten und bei tertiären am geringsten. Mit zunehmendem Substitutionsgrad findet jedoch auch eine zunehmende sterische Hinderung bei der Hydratisierung. Beides zusammen führt zu einer veränderten Reihenfolge der Basizität in wässrigen Lösungen:
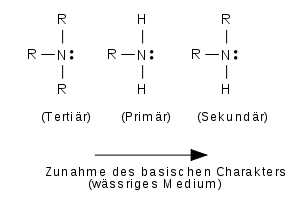
Die Basizität aliphatischer Amine ist wegen des +I-Effekts größer als die von Ammoniak, die aromatischer Amine ist deutlich geringer, da hier der –I-Effekt der aromatischen Ringe zum Tragen kommt. In wässriger Lösung zeigen Alkylamine folgende Reihenfolge der Basizität: primär < sekundär > tertiär
Der Abfall der Basizität tertiärer Amine liegt an der schlechteren Solvatation der Ammoniumionen durch das Wasser; in der Gasphase sind sie stärker basisch als sekundäre Amine.
Physikalische Eigenschaften
Monomethylamin, Dimethylamin und Trimethylamin sowie Ethylamin sind bei Raumtemperatur gasförmig, die folgenden Glieder sind flüssig, noch höhere Homologe fest. Amine weisen, soweit sie flüchtig genug sind, häufig einen ammoniak- oder fischartigen Geruch auf, der weniger stechend als der von Ammoniak ist.
Infolge ihrer Polarität sind Amine viel besser in Wasser löslich als vergleichbare Kohlenwasserstoffe; mit steigender Länge der Alkylketten nimmt die Wasserlöslichkeit ab. Primäre und sekundäre Amine sind über Wasserstoffbrückenbindungen assoziiert; dies führt – ähnlich wie bei Alkoholen – zu höheren Siedepunkten im Vergleich zu analogen Kohlenwasserstoffen
Herstellung
Bei biologischen Vorgängen entstehen Amine unter Anderem durch Decarboxylierung von Aminosäuren oder durch Transaminierung von Aldehyden.
Präparativ sind Amine durch Alkylierung von Ammoniak, z. B. mit Alkylhalogeniden, zugänglich, wobei man hierbei Gemische aller Alkylierungsstufen erhält, da die zunächst gebildeten primären Amine ebenfalls alkyliert werden, ebenso die sekundären usw..
Zur Darstellung primärer Aminen wird häufig die Gabrielsynthese benutzt. Bei dieser wird zunächst Phthalimid mit dem entsprechenden Alkylhalogenid umgesetzt und anschließend mit Natronlauge basisch aufgearbeitet (als schonende Alternative hat sich die Aufarbeitung mit Hydrazin durchgesetzt), um das primäre Amin freizusetzten. Primäre Amine lassen sich auch durch den Carbonsäureamid-Abbau nach Hofmann herstellen, dabei wird die Kohlenstoffkette um ein Kohlenstoffatom verkürzt. Die sekundären Amine lassen sich auf mehreren Wegen herstellen. Zunächst ist es möglich, Anilin zweimal zu alkylieren und anschließend den aromatischen Ring an der para-Position zu nitrieren. Eine basische Aufarbeitung führt zum gewünschten Amin. Alternativ lassen sich sekundäre Amine aus Iminen (R-CH=N-R') durch Hydrierung der Doppelbindung synthetisieren. Besonders für tertiäre Amine eignet sich die Leuckart-Wallach-Reaktion.
Technische Verfahren zur Herstellung von Aminen sind die Umsetzung von Ammoniak mit Alkoholen (z. B. Alkylamine wie Methyl- und Ethylamine) oder Aldehyden bzw. Ketonen (z. B. Isopropylamine), die Reduktion von Nitrilen (z. B. Fettamine) sowie die Umsetzung mit Chloralkanen (insbesondere Feinchemikalien und quartäre Ammoniumsalze). Im großtechnischen Maßstab wird auch die Umsetzung von Epoxiden mit Aminen bzw. Ammoniak durchgeführt (Ethanolamine, Isopropanolamine, etc.). Aromatische Amine werden durch Nitrierung und anschließende Reduktion hergestellt (z. B. Anilin, Toluidin, etc.). Die Nitrierung von Alkanen und anschließende Reduktion zum Alkylamin sowie die Hydroaminierung von Olefinen hat technisch nur eine geringe Bedeutung. Sie werden jedoch beide ebenfalls im technischen Maßstab betrieben.
Vorkommen
Die in Pflanzen, Tieren und dem Menschen natürlich vorkommenden, biogenen Amine besitzen große Bedeutung als Gewebshormone, Transmethylierungspartner oder Transmitter-Substanzen. Außerdem findet man Amin-Derivate als Basen in der DNA. Auch Aminosäuren, die Bausteine von Peptiden, sind Amine. Die im Eiweiß von Fischen enthaltenen Aminosäuren werden nach dem Tod der Tiere biologisch zu Aminen und Kohlenstoffdioxid abgebaut. Die entstandenen Amine sind verantwortlich für den charakteristischen Geruch des Fisches. Da dieser in der Gastronomie nicht überhand nehmen soll, wird Fisch meist mit einem Stückchen Zitrone serviert. Zitronensäure protoniert (wie alle anderen Säuren auch) Amine und verhindert so einen intensiven Geruch.
Verwendung
Amine werden zur Herstellung von Azoverbindungen verwendet, z. B. bei der Herstellung von Farbstoffen, als Reaktanden bei zahlreichen Nucleophilen Substitutionen zur Bildung von beispielsweise Carbonsäureamiden/imiden oder Lactonen und Iminen, weswegen Amine als Schutzgruppen von Carbonylen eingesetzt werden können oder als chirale Auxiliare. Bei Eliminierungen werden voluminöse sekundäre oder tertiäre Amine als Protonenakzeptoren genutzt, die zwar basisch, aber nicht nucleophil sind. Weiterhin finden Amine, meist Diamine oder Triamine, Anwendung als Liganden in der Komplexchemie.
Im Bereich der Gießereitechnik findet Amin als Katalysator Anwendung um den Aushärtvorganges der Bindemittel im Formsand bei der Kernherstellung nach dem Cold-Box-Verfahren zu beschleunigen. Als Katalysatoren dienen Amine auch zur Herstellung von Polyurethanen. Ihre puffernde Wirkung wird genutzt, wenn sie in wässrigen Systemen als Korrosionsinhibitoren eingesetzt werden. Ein weiteres wichtiges Anwendungsfeld ist die Gaswäsche in Raffinerien und Kraftwerken.
Darüber hinaus sind Amine Bausteine für Agro- und Pharmachemikalien sowie für Tenside, Coatings und Schmierstoffe.
Nachweis von Aminen
Amine sind oft schon durch ihren charakteristischen stechenden Geruch erkennbar (ammoniakartig bis fischig). Dies reicht aber für einen Nachweis nicht aus.
Zum Nachweis des Stickstoffs kann ein Natrium-Aufschluss der zu untersuchenden Substanz durchgeführt werden. In der neutralisierten Aufschluss-Lösung kann Stickstoff als Cyanid mit der Laissagne-Probe als Berliner Blau nachgewiesen werden, oder, falls die Substanz gleichzeitig Schwefel enthielt, als Thiocyanat mit Eisen(III)-chlorid. Diese Nachweise sind allerdings nicht spezifisch für Amine, sondern zeigen nur an, dass die Analysensubstanz Stickstoff enthielt.
Dann kann der Substitutionsgrad des Amins nachgewiesen werden, also ob ein primäres/sekundäres/tertiäres Amin vorliegt. Dazu wird die Hinsberg-Trennung durchgeführt. Hierbei wird das Amin zu p-Toluolsulfonsäureamid umgesetzt:
- Tertiäre Amine und quartäre Ammoniumsalze bilden keine Sulfonamide,
- Sekundäre Amine bilden Sulfonamide, die nicht in Alkali löslich sind,
- Primäre Amine bilden Sulfonamide, die in Alkali löslich sind
Die eindeutige Identifizierung eines unbekannten Amins erfolgt entweder spektrometrisch oder über ein geeignetes Derivat:
- Primäre & Sekundäre Amine: Als Derivat eignet sich das aus der Hinsberg-Trennung bereits gewonnene Sulfonamid (siehe oben).
- Tertiäre Amine: Hier ist die Fällung des Pikrates zu empfehlen.
Siehe auch
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 22. Auflage 1991, ISBN 3-7776-0485-2
- Autorengemeinschaft: Organikum, 22. Auflage, Wiley-VCH, Weinheim, 2004, ISBN 3-527-31148-3
Weblinks
- Pflanzliche Amine
- Erklärung vom basischen Character von Aminen bei TutorVista.com (Englisch)
- Tabellen mit pKb-Werten von verschiedenen Aminen
Wikimedia Foundation.
