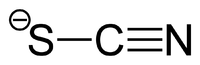- Thiocyanate
-
Als Thiocyanate (veraltet auch Rhodanide) werden die Salze und die Ester der unbeständigen Thiocyansäure (Rhodanwasserstoffsäure) HSCN bezeichnet. Der Name „Rhodanid“ leitet sich von griechisch "rhodos" für "rot" ab, da Eisen(III)-thiocyanat eine tiefrote Farbe besitzt. Die Salze lassen sich am einfachsten durch Schmelzen der entsprechenden Cyanide mit Schwefel herstellen [1]
Kaliumthiocyanat ist das bekannteste Salz und wird unter anderem für den Nachweis von Fe3+-Ionen verwendet, wobei das tiefrot gefärbte Eisen(III)-thiocyanat Fe(SCN)3 entsteht.
Das Thiocyanat-Ion (NCS−) kann als Ligand in Komplexen sowohl über das Stickstoff-Atom als auch über das Schwefel-Atom an das Zentralatom koordinieren, daher tritt es in der spektrochemischen Reihe zweimal auf. In seinem chemischen Verhalten ähnelt es den Halogeniden und wird daher zur Gruppe der Pseudohalogenide gezählt.
Die menschliche Leber erzeugt Thiocyanat beim Abbau von Cyaniden durch das Enzym Rhodanid-Synthetase. Auch aus einigen Nahrungsmitteln, wie Kohl, können Thiocyanate aus den darin enthaltenen Senfölglykosiden, wie etwa Glucobrassicin, enzymatisch freigesetzt werden. Da das Thiocyanat-Ion die Iodaufnahme in der Schilddrüse verhindert, kann es bei übermäßigem Verzehr (je nach Art 0,5 bis mehrere kg pro Tag) von Kohl zur Ausbildung eines Kropfs („Kohlkropf“) kommen[2].
Thiocyanat entsteht ebenfalls als Stoffwechselprodukt beim Abbau von Tabakprodukten im Körper. Über diesen Weg kann Tabakkonsum von Personen nachgewiesen werden.
Die Ester R−S−C≡N (R = organischer Rest, wie Alkylrest, Arylrest etc.) der Thiocyansäure sind Konstitutions-Isomere der Isothiocyansäureester R-N=C=S. Sie riechen knoblauchartig und sind nur wenig beständig[1].
Einzelnachweise
- ↑ a b Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
Weblinks
 Wikibooks: Praktikum Anorganische Chemie/ Thiocyanat – Lern- und Lehrmaterialien
Wikibooks: Praktikum Anorganische Chemie/ Thiocyanat – Lern- und Lehrmaterialien
Wikimedia Foundation.