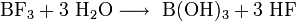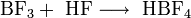- Trifluorboran
-
Strukturformel 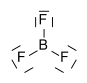
Allgemeines Name Bortrifluorid Andere Namen - Trifluorboran
- Bor(III)-fluorid
Summenformel BF3 CAS-Nummer 7637-07-2 Kurzbeschreibung farbloses, an feuchter Luft rauchendes Gas Eigenschaften Molare Masse 67,8062 g·mol−1 Aggregatzustand gasförmig[1]
Dichte 0,0031 g·cm−3[1]
Schmelzpunkt −127,1 °C[1]
Siedepunkt −100,4 °C[1]
Löslichkeit reagiert heftig mit Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Sehr giftig Ätzend (T+) (C) R- und S-Sätze R: 14-26-35 S: (1/2)-9-26-28-36/37/39-45 MAK 2,5 mg/m3 (Fluorid)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bortrifluorid ist eine chemische Verbindung, bestehend aus den Elementen Bor und Fluor. Es besitzt die Summenformel BF3 und wird manchmal auch als Trifluorboran bezeichnet.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bortrifluorid kann gewonnen werden durch:
- Reaktion von Bortrioxid mit Flusssäure:
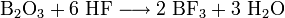
- im großtechnischen Bereich durch Erhitzen von Dibortrioxid oder Borax mit Calciumfluorid und konzentrierter Schwefelsäure
- im Labor durch Thermolyse von Diazoniumtetrafluorboraten
- weiter aus Kalium- oder Natriumfluoroborat und Bortrioxid
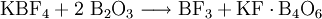
- oder aus Fluorsulfonsäure und Borsäure:[3]
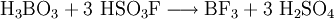
Eigenschaften
Bortrifluorid bildet eine trigonal-planar Molekülstruktur aus. Es ist eine sehr giftige, bei Raumtemperatur gasförmige chemische Verbindung, die eine kritische Temperatur von −12,3 °C besitzt.
Bortrifluorid ist eine sehr starke Lewis-Säure. Es bildet mit Elektronenpaardonoren Additionsverbindungen. Mit Wasser reagiert es unter Zersetzung zu Borsäure und Flusssäure.
Allerdings ist die Hydrolyse im Gegensatz zu anderen Borhalogeniden nicht vollständig, da sich auch das inerte, tetraedrische Tetrafluoroboration (BF4-) bildet.
Verwendung
In der chemischen Industrie kann Bortrifluorid für eine Vielzahl von chemischen Reaktionen als Katalysator bzw. Ausgangsstoff zur Herstellung verschiedener Borverbindungen eingesetzt wird. Gasförmiges Bortrifluorid und Bortrifluorid-Addukte werden hauptsächlich als Katalysatoren oder Co-Katalysatoren benutzt, zum Beispiel bei der Herstellung von Polymeren, hochwertigen Schmierölen, Pharmazeutika, Aroma- und Duftstoffen und weiteren Feinchemikalien sowie zur Synthese von Borverbindungen wie zum Beispiel Alkylboranen, Aminboranen und Reagenzien für die Suzuki-Kupplung. Weiterhin wird es in der Halbleiterindustrie als Borlieferant für die Ionenimplantation (p-Dotierung), zur Oberflächenbehandlung von Stahl und Glas und in Neutronendetektoren verwendet.
Sicherheitshinweise
Bortrifluorid ist sehr giftig.
Wichtige BF3-Addukte
- BF3-Methanol
- BF3-Phenol
- BF3-Dibutylether
- BF3-Diethylether
- BF3-Dimethylether
- BF3-THF (Tetrahydrofuran)
- BF3-Essigsäure
- BF3-Acetonitril
- BF3-Dihydrat
- BF3-Phosphorsäure
Quellen
- ↑ a b c d e f Sicherheitsdatenblatt (alfa-aesar)
- ↑ Eintrag zu CAS-Nr. 7637-07-2 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 219-21.
Wikimedia Foundation.