- Bortrifluorid
-
Strukturformel 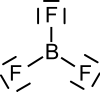
Allgemeines Name Bortrifluorid Andere Namen - Trifluorboran
- Bor(III)-fluorid
Summenformel BF3 CAS-Nummer 7637-07-2 PubChem 6356 Kurzbeschreibung farbloses, stechend riechendes, an feuchter Luft rauchendes Gas[1]
Eigenschaften Molare Masse 67,81 g·mol−1 Aggregatzustand gasförmig[2]
Dichte 3,1 g·l−1[2]
Schmelzpunkt Siedepunkt −100,4 °C[2]
Löslichkeit reagiert heftig mit Wasser[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 330-314-280 EUH: 014-071 P: 260-280-304+340-303+361+353-305+351+338-315-405-403 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Sehr giftig Ätzend (T+) (C) R- und S-Sätze R: 14-26-35 S: (1/2)-9-26-28-36/37/39-45 MAK 2,5 mg·m−3 (Fluorid)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bortrifluorid ist eine chemische Verbindung, bestehend aus den Elementen Bor und Fluor. Es besitzt die Summenformel BF3 und wird manchmal auch als Trifluorboran bezeichnet.
Inhaltsverzeichnis
Gewinnung und Darstellung
Bortrifluorid kann gewonnen werden durch:
- Reaktion von Bortrioxid mit Flusssäure:
- im großtechnischen Bereich durch Erhitzen von Dibortrioxid oder Borax mit Calciumfluorid und konzentrierter Schwefelsäure
- im Labor durch Thermolyse von Diazoniumtetrafluoroboraten
- weiter aus Kalium- oder Natriumfluoroborat und Bortrioxid
- oder aus Fluorsulfonsäure und Borsäure:[5]
Eigenschaften
Bortrifluorid bildet eine trigonal-planare Molekülstruktur aus. Es ist eine sehr giftige, bei Raumtemperatur gasförmige chemische Verbindung, die eine kritische Temperatur von −12,3 °C besitzt.
Bortrifluorid ist eine sehr starke Lewis-Säure. Es bildet mit Elektronenpaardonoren Additionsverbindungen.
Mit Wasser reagiert es unter Zersetzung zu Borsäure und Flusssäure. Im Gegensatz zu den anderen Bortrihalogeniden findet keine direkte Hydrolyse statt, sondern eine Abfolge mehrerer Reaktionen. Dabei bildet sich aufgrund der starken BF3-Bindung zunächst ein Lewis-Säure-Base-Addukt.
Allerdings ist die Hydrolyse im Gegensatz zu anderen Borhalogeniden nicht vollständig, da sich auch das inerte, tetraedrische Tetrafluoroboration (BF4-) bildet.
Auch die Produkte der Hydrolyse reagieren weiter zur Tetrafluorborsäure, die als Oxoniumsalz vorliegt.
Verwendung
In der chemischen Industrie kann Bortrifluorid für eine Vielzahl von chemischen Reaktionen als Katalysator bzw. als Ausgangsstoff zur Herstellung verschiedener Borverbindungen eingesetzt werden. Gasförmiges Bortrifluorid und Bortrifluorid-Addukte werden hauptsächlich als Katalysatoren oder Co-Katalysatoren benutzt, zum Beispiel bei der Herstellung von Polymeren, hochwertigen Schmierölen, Pharmazeutika, Aroma- und Duftstoffen und weiteren Feinchemikalien sowie zur Synthese von Borverbindungen wie zum Beispiel Alkylboranen, Aminboranen und Reagenzien für die Suzuki-Kupplung. Weiterhin wird es in der Halbleiterindustrie als Borlieferant für die Ionenimplantation (p-Dotierung), zur Oberflächenbehandlung von Stahl und Glas und in Neutronendetektoren verwendet.
Sicherheitshinweise
Bortrifluorid ist sehr giftig und stark ätzend.
Wichtige BF3-Addukte
- BF3-Methanol
- BF3-Phenol
- BF3-Dibutylether
- BF3-Diethylether
- BF3-Dimethylether
- BF3-THF (Tetrahydrofuran)
- BF3-Essigsäure
- BF3-Acetonitril
- BF3-Dihydrat
- BF3-Phosphorsäure
Einzelnachweise
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f Datenblatt Bortrifluorid bei AlfaAesar, abgerufen am 22. Februar 2010 (JavaScript erforderlich)..
- ↑ a b Eintrag zu CAS-Nr. 7637-07-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. März 2011 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7637-07-2 im European chemical Substances Information System ESIS
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 219-21.
Schlagen Sie auch in anderen Wörterbüchern nach:
Bortrifluorid — Bor|tri|flu|o|rid; Syn.: Trifluorboran: BF3; farbloses, giftiges, an Luft rauchendes Gas, das als starke ↑ Lewis Säure bes. in Form von Komplexen wie Bortrifluorid Etherat (Diethylether Trifluorboran, Sdp. 126 °C) Verwendung findet zur Katalyse… … Universal-Lexikon
Bor(III)-fluorid — Strukturformel Allgemeines Name Bortrifluorid Andere Namen Trifluorboran Bor(III) fluorid … Deutsch Wikipedia
Trifluorboran — Strukturformel Allgemeines Name Bortrifluorid Andere Namen Trifluorboran Bor(III) fluorid … Deutsch Wikipedia
Liste der UN-Nummern — UN Nummern, auch Stoffnummern genannt, sind von einem Expertenkomitee der Vereinten Nationen (UN) festgelegte, vierstellige Nummern, die für alle gefährlichen Stoffe und Güter (Gefahrgut) festgelegt wurden. Inhaltsverzeichnis 1 0000–0099 2… … Deutsch Wikipedia
B2H6 — Strukturformel Allgemeines Name Diboran Andere Namen Borethan Diborhexahydrid … Deutsch Wikipedia
Borethan — Strukturformel Allgemeines Name Diboran Andere Namen Borethan Diborhexahydrid … Deutsch Wikipedia
Diborhexahydrid — Strukturformel Allgemeines Name Diboran Andere Namen Borethan Diborhexahydrid … Deutsch Wikipedia
Alder-En-Reaktion — Die En Reaktion, auch Alder En Reaktion genannt, ist eine chemische Reaktion aus dem Bereich der Organischen Chemie. Es handelt sich um eine pericyclische Reaktion, bei der ein Alken, welches ein Wasserstoff in allylischer Position trägt, mit… … Deutsch Wikipedia
Aromatische elektrophile Substitution — Unter der elektrophilen aromatischen Substitution abgekürzt als SEAr versteht man eine elektrophile Substitutionsreaktion an einer aromatischen Verbindung. Während bei Aliphaten Substitutionen häufig nukleophiler Natur sind, werden Aromaten… … Deutsch Wikipedia
Boronion — Strukturformel (R) α Jonon (S) α Jonon … Deutsch Wikipedia





![\mathrm{ H_2O^{+-}BF_3 + H_2O\ \rightleftharpoons \ [H_3O][BF_3OH]}](b/0fb268c37320846d171cc27e876a8fd1.png)
![\mathrm{ [H_3O][BF_3OH] + H_2O\ \rightleftharpoons \ B(OH)_3 + 3\ HF}](c/feca66a93d76a8ecd2bd29c429f2e335.png)

![\mathrm{ B(OH)_3 + 4\ HF\ \rightleftharpoons \ [H_3O][BF_4] + 2\ H_2O}](b/0bb10efd0beb2cfb90aa590a8a1ca5ba.png)
