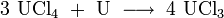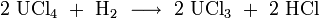- UCl3
-
Kristallstruktur 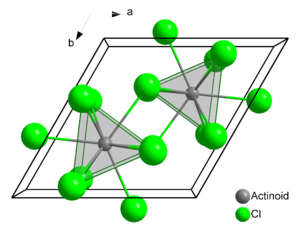
Kristallsystem hexagonal Raumgruppe 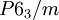
Gitterkonstanten a = 745,2 pm
c = 432,8 pmKoordinationszahlen U[9], Cl[3] Allgemeines Name Uran(III)-chlorid Andere Namen Urantrichlorid
Verhältnisformel UCl3 CAS-Nummer 10025-93-1 PubChem 167444 Kurzbeschreibung rote Kristalle[1] Eigenschaften Molare Masse 344,387 g/mol Aggregatzustand fest
Dichte 5,50 g/cm3[2]
Schmelzpunkt 837 °C[2]
Siedepunkt 1657 °C[2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/28-33-51/53 S: (1/2)-20/21-45-61 Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Uran(III)-chlorid (UCl3) ist ein Chloridsalz des Urans in der Oxidationsstufe +3. Es ist ein Zwischenprodukt in der Wiederaufarbeitung abgebrannter Kernbrennstoffe.
Inhaltsverzeichnis
Darstellung
Es gibt zwei Wege zur Synthese von Uran(III)-chlorid. Zum einen kann es durch die Umsetzung von metallischem Uran in einer Salzschmelze aus Natriumchlorid und Kaliumchlorid bei 670–710 °C erhalten werden.[4]
Eine weitere Möglichkeit besteht in der Erhitzung von Uran(IV)-chlorid unter Wasserstoffatmosphäre.[5]
Eigenschaften
Bei Raumtemperatur ist Uran(III)-chlorid ein roter, sehr hygroskopischer, kristalliner Feststoff, der sehr gut in Wasser löslich ist. UCl3 besitzt eine geringere Stabilität als Uran(IV)-chlorid (UCl4), da die Oxidationsstufe +3 in saurer Lösung stabilisiert wird. In salzsaurer Lösung besitzt UCl3 eine höhere Stabilität als in Wasser.[6] Uran(III)-chlorid schmilzt bei 837 °C und siedet bei 1657 °C, es hat eine Dichte von 5,50 g/cm3.
Drei Hydrate des Uran(III)-chlorids sind bekannt:
- UCl3 · 2 H2O · 2 CH3CN
- UCl3 · 6 H2O
- UCl3 · 7 H2O
Sie werden durch Reduktion von Uran(IV)-chlorid in Acetonitril in Gegenwart von Wasser und Propionsäure hergestellt.[7]
Kristallstruktur
Die Struktur des Uran(III)-chlorids ist die Leitstruktur für eine Reihe weiterer Verbindungen. In dieser werden die Uranatome von je neun Chloratomen umgeben. Als Koordinationspolyeder ergibt sich dabei ein dreifach überkapptes, trigonales Prisma, wie sie auch bei den späteren Actinoiden und den Lanthanoiden häufig anzutreffen ist. Es kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/m mit den Gitterparametern a = 745 pm und c = 433 pm und zwei Formeleinheiten pro Elementarzelle.[8] Weitere Verbindungen, die in einer Uran(III)-chloridstruktur kristallisieren, sind unter anderem Neptunium(III)-chlorid, Plutonium(III)-chlorid, Americium(III)-chlorid, Curium(III)-chlorid und Antimon(III)-chlorid.
Verwendung
Uran(III)-chlorid wird zur Darstellung verschiedener Uranmetallocene verwendet, zum Beispiel in Reaktionen mit Tetrahydrofuran (THF) und Methylcyclopentadienylnatrium.[9] Uran(III)-chlorid kann auch als Katalysator Verwendung finden beispielsweise bei Reaktionen zwischen Lithiumaluminiumhydrid (LiAlH4) und Alkenen, zur Synthese von Alkylaluminiumverbindungen.[10]
Uran(III)-chlorid wird in Salzschmelzen eingesetzt und spielt eine Rolle bei der Wiederaufarbeitung abgebrannter Kernbrennstoffe.[11][12]
Sicherheitshinweise
Ähnlich wie andere lösliche Uranverbindungen wird UCl3 leicht resorbiert.[13] Es ist hochtoxisch beim Einatmen und Verschlucken. Außerdem besteht die Gefahr der Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft. Für Wasserorganismen ist es ebenfalls giftig und kann Langzeitschäden in der Wasserwelt verursachen. Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig.
Einzelnachweise
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, S. 1969; ISBN 978-3-11-017770-1.
- ↑ a b c Uran(III)-chlorid bei www.webelements.com.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Uranverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2009 (JavaScript erforderlich)
- ↑ Serrano, K.; Taxil, P.; Dugne, O.; Bouvet, S.; Puech, E.: J. Nucl. Mater. 2000, 282, 137–145.
- ↑ Remsen, Ira: Inorganic Chemistry, New York: Henry Holt and Company, 1890.
- ↑ Comey, Arthur M. and Hahn, Dorothy A. A Dictionary of Chemical Solubilities: Inorganic. New York: The MacMillan Company, 1921.
- ↑ Mech, A.; Karbowick, M.; Lis, T.: Polyhedron 2006, 25, 2083–2092.
- ↑ Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements: Bd. 3, 2006, Springer, ISBN 1-4020-3555-1.
- ↑ Brenna, J.G.; Anderson, R.A.; Zalkin, A.: Inorg. Chem. 1986, 25, 1756–1760.
- ↑ Le Marechal, J.F.; Ephritikhine, M.; Folcher, G. J.: Organomet. Chem. 1986, 309, C1–C3.
- ↑ Okamoto, Y.; Madden, P.; Minato, K.: J. Nucl. Mater. 2005, 344, 109–114.
- ↑ Okamoto, Y.; Kobayashi, F.; Ogawa, T.: J. Alloys Compd. 1998, 271, 355–358.
- ↑ Bertell, Rosalie: "Gulf War Veterans and Depleted Uranium." May 1999.
Literatur
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
Weblinks
Wikimedia Foundation.