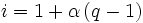- Van ’t Hoff-Faktor
-
In der Physikalischen Chemie bezeichnet der „Van ’t Hoff“-Faktor i das Verhältnis der Stoffmenge eines gelösten Stoffs (Soluts) in einer wässrigen Lösung zur Stoffmenge des ursprünglich zugegebenen Ausgangsstoffs. Der Faktor ist damit ein Maß dafür, in welchem Unfang der gelöste Stoff dissoziiert. Die Bezeichnung geht auf Jacobus Henricus van ’t Hoff zurück, den ersten Träger des Nobelpreises für Chemie.
Inhaltsverzeichnis
Berechnung
Die Berechnung des Van ’t Hoff-Faktors erfolgt über folgende Gleichung:
wobei α der Dissoziationsgrad und q die Anzahl der in Lösung befindlichen Ionen des Stoffes ist.
Beispiele
Als Beispiel hat Glucose einen „Van ’t Hoff“-Faktor von 1, denn sie ist undissoziiert in Wasser löslich. Demgegenüber ist der „Van ’t Hoff“-Faktor von Natriumchlorid gleich 2, denn ein Mol NaCl dissoziiert in je ein Mol Na+ und Cl-. Stoffe wie schwache Elektrolyte, die nur teilweise dissoziieren, haben folglich einen gebrochenen „Van ’t Hoff“-Faktor je nach dem jeweiligen Dissoziationsgleichgewicht.
Bedeutung
Der „Van ’t Hoff“-Faktor spielt vor allem bei kolligativen Prozesse eine wichtige Rolle, da es hier auf die absolute Teilchenzahl und nicht die Art der Teilchen ankommt. Zum Beispiel ist der osmotische Druck einer Kochsalzlösung annähernd doppelt so hoch wie der einer Zuckerlösung mit gleicher Stoffmengenkonzentration.
Quellen
Römpp CD 2006, Georg Thieme Verlag 2006
Wikimedia Foundation.