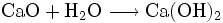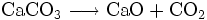- Weichbrannt
-
Kristallstruktur 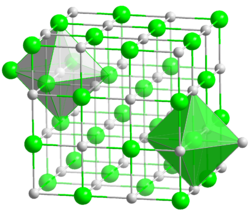
__ Ca2+ __ O2− Kristallsystem kubisch Raumgruppe 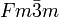
Koordinationszahlen Ca[6], O[6] Allgemeines Name Calciumoxid Andere Namen - gebrannter Kalk
- Branntkalk
- ungelöschter Kalk
- Ätzkalk
- Freikalk
Verhältnisformel CaO CAS-Nummer 1305-78-8 Kurzbeschreibung weißes Pulver Eigenschaften Molare Masse 56,08 g·mol−1 Aggregatzustand fest
Dichte 3,37 g·cm−3 (20 °C)>[1]
Schmelzpunkt 2570–2580 °C[1]
Siedepunkt 2850 °C (100 mbar)[1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Ätzend (C) R- und S-Sätze R: 34 S: 26-36/37/39-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Calciumoxid, auch gebrannter Kalk, Branntkalk, ungelöschter Kalk oder Ätzkalk, ist ein weißes Pulver, das mit Wasser unter starker Wärmeentwicklung reagiert. Durch die Reaktion mit Wasser wird Calciumhydroxid (gelöschter Kalk) gebildet:
Gebrannter Kalk wird in Weichbrannt und Hartbrannt unterschieden.
Herstellung
- Hauptartikel: Technischer Kalkkreislauf
Im Industriemaßstab wird Calciumoxid durch Kalkbrennen hergestellt. Ab einer Temperatur von etwa 800 °C wird Kalkstein (Calciumcarbonat) entsäuert, das heißt Kohlendioxid wird ausgetrieben und es entsteht Calciumoxid.
CaCO3-Entsäuerung in der DTAMan unterscheidet die Branntkalke u.a. nach ihrer Reaktionsgeschwindigkeit des Kalkes mit Wasser (den Löschprozess zu Löschkalk):
- < 2 min Reaktionsdauer: Weichbranntkalk
- 2–6 min Reaktionsdauer: Mittelbranntkalk
- > 6 min Reaktionsdauer: Hartbranntkalk
Es existieren allerdings keine präzisen Definitionen.
Die Unterschiede in der Reaktionsgeschwindigkeit sind eine Folge von Kristallitgröße des CaO, Porenvolumen und spezifischer Oberfläche, die durch Brenntemperatur und auch -dauer beeinflusst werden.
Weichgebrannter Kalk entsteht bei Temperaturen von 900–1000 °C, hartgebrannter Kalk bei bis zu 1400 °C, wobei auch die Zeitdauer der Temperatureinwirkung und vor allem die petrographische Ausbildung des Kalksteins eine Rolle spielen.
Wenn kleinere Mengen (Labormaßstab) ausreichen, kann man es durch Oxidieren von Calcium gewinnen.
Reaktionsfähiges Calciumoxid erhält man durch thermisches Zersetzen von Calciumhydroxid, welches bei 550 °C unter Atmosphärendruck in Calciumoxid und Wasser zerfällt. Das unter diesen Bedingungen entstandene Calciumoxid ist wenig kristallin, also gut reaktionsfähig.
Gebrannter (ungelöschter) Kalk und gelöschter Kalk (Calciumhydroxid) sind stark ätzend (pH-Wert 12–13), Kontakt mit den Augen kann zur Erblindung führen!
Verwendung
Branntkalk wird in der Bauindustrie als Beimischung zu Mörtel verwendet, und zur industriellen Fertigung von Kalksandsteinen, außerdem ist er ein untergeordneter Bestandteil von Zementklinker. In der Chemie nutzt man die Substanz außerdem als Trocknungsmittel und zur Absorption von Kohlenstoffdioxid. Weitere Einsatzbereiche von Branntkalk sind z. B. Düngekalk, die Produktion von Calciumcarbid sowie seine Nutzung zur Herstellung von Kalkmörtel, Kalkputz und Kalkfarbe und zur Nutzung als Neutralisationsmittel.
Einer der wesentlichen Einsatzbereiche ist die Entschwefelung von Roheisen, wo der Schwefel [S] als Begleiter [FeS] vorkommt und auf dem Weg zum Stahl (Konverter) heraus gelöst werden muss. Dabei wird Kalk (CaO) entweder in das Roheisen eingeblasen oder mit einem Rührer eingemischt. Der Kalk verbindet sich mit dem Schwefel zu Calciumsulfid [CaS] und steigt zur Oberfläche auf und setzt sich dort als Schlacke ab. Die wird nach dem Entschwefeln mit einer Abkratzmaschine entfernt.
Eine wichtige Anwendung findet Calciumoxid als Vorstufe bei der Herstellung von Calciumhydroxid durch Zugabe von Wasser (gelöschter Kalk oder Löschkalk).
Der gelöschte Kalk wird unter anderem als Alternative zum Kalkstein in der Rauchgasentschwefelung eingesetzt. Die Einsatzmenge ist hierbei ca. 1,8-fach geringer als für Kalkstein. Der dabei aus Branntkalk gewonnene Gips (Calciumsulfat) hat einen Weißgrad von 80 % und kann kommerziell weiterverwendet werden. Durch seine hohe Reaktivität werden geringere Verbrauchmengen benötigt. Nachteil ist sein deutlich höherer Preis gegenüber Kalkstein.
Durch Reaktion mit Chlor kann aus Calciumhydroxid Chlorkalk hergestellt werden.
Es wird Lebensmitteln als Säureregulator zugesetzt. Es wird in erster Linie als sogenannter technischer Hilfsstoff eingesetzt, der im fertigen Lebensmittel nicht mehr vorhanden ist. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 529 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Früher wurde Calciumoxid zur Kaustifizierung von Soda und Pottasche eingesetzt, was für die Seifenherstellung von großer Bedeutung war.
Quellen
- ↑ a b c d Eintrag zu Calciumoxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 23.10.2008 (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt (Merck)
Wikimedia Foundation.