- Zytostatisch
-
Zytostatika (oder Cytostatika, vom griechischen Cyto = Zelle und statik = anhalten) sind natürliche oder synthetische Substanzen, die das Zellwachstum bzw. die Zellteilung hemmen. Sie werden vor allem zur Behandlung von Krebs (Chemotherapie), teilweise auch bei der Behandlung von Autoimmunerkrankungen eingesetzt. Neben den klassischen Zytostatika werden heute in der Behandlung von Tumorerkrankungen auch weitere Substanzen wie z. B. Hormone, therapeutische monoklonale Antikörper, Zytokine und sogenannte „small molecules“ wie z. B. Signaltransduktions-Inhibitoren, Proteasominhibitoren etc. eingesetzt.
Inhaltsverzeichnis
Geschichte
Während des Ersten Weltkriegs stellten Ärzte fest, dass das Kampfgas Schwefel-Lost (Senfgas) antiproliferative (wachstumshemmende) Wirkung hat. Nach dem Krieg wurde der weniger giftige Stickstoff-Lost (= Mechlorethamin) entwickelt und um 1942 als erstes Zytostatikum in der Medizin eingesetzt. Bis heute ist Stickstoff-Lost in den USA zugelassen; seine Derivate sind in zahlreichen modernen Behandlungsschemata enthalten. Die zytostatische Wirkung der Platinkomplexe wurde 1965 zufällig bei einem Versuch mit Zellkulturen und einer Platinelektrode entdeckt. Andere Substanzen wie Mitotan und die Vinca-Alkaloide wurden in der Pharmaindustrie in ganz anderen Bereichen entwickelt, fielen jedoch beim Tierversuch durch ihr wachstumshemmendes Potential auf.
Antikörper
Seit Anfang der 1990er Jahre werden zunehmend monoklonale Antikörper gegen Oberflächenantigene von Tumorzellen entwickelt. Der Antikörper gegen CD-20 Rituximab ist mittlerweile eine „Standardwaffe“ gegen maligne Lymphome (Lymphdrüsenkrebs). Weitere therapeutische Antikörper sind Trastuzumab, das bei bestimmten Formen von Brustkrebs eingesetzt wird sowie Cetuximab und Bevacizumab, welche bei Darmkrebs wirksam sind. Man erhofft sich von der Immuntherapie in den nächsten Jahrzehnten eine Revolution in der Behandlung von Krebserkrankungen.
Antikörper und andere Immuntherapeutika wie Interferon sind im engeren Sinne keine Zytostatika, da sie nicht direkt die Zellteilung bzw. das Zellwachstum hemmen.
Wirkmechanismus
Zytostatika stören die Stoffwechselvorgänge, die im Zusammenhang mit Zellwachstum oder Zellteilung stehen. Daher schädigen sie vor allem schnell wachsende Zellen wie Epithelzellen (u. a. Haarwurzelzellen, Schleimhautepithel von Mund und Magen-Darm-Trakt). Da Tumorzellen eine erhöhte Zellteilungsrate und eine eingeschränkte Reparaturkapazität haben, sind sie etwas empfindlicher gegenüber Zytostatika als gesunde Zellen. Dieser Unterschied ermöglicht erst die Therapie mit diesen – sehr toxischen – Substanzen.
Nebenwirkungen
Da die Giftwirkung auch gesunde Zellen beeinträchtigt, kommt es zu vielerlei negativen Begleiterscheinungen. Insbesondere die Schleimhaut des Magen-Darmtraktes und das blutbildende Knochenmark sind empfindlich. Fast alle Zytostatika verursachen in unterschiedlichem Ausmaß vorübergehenden Haarausfall, Übelkeit und Erbrechen und eine Verminderung der weißen und/oder roten Blutkörperchen im Blut (Knochenmarksdepression). Darüber hinaus haben die einzelnen Wirkstoffgruppen noch weitere, unterschiedliche Nebenwirkungen. Einige Zytostatika sind selbst karzinogen (krebserregend) und mutagen (keimbahnschädigend).
Obwohl heutzutage komplexe Begleitbehandlungen zu den Zytostatika eingesetzt werden, muss noch immer ein Teil der Therapien dosisreduziert, unterbrochen oder gar abgebrochen werden.
Die WHO-Einteilung der Nebenwirkungen in Schweregrade richtet sich nach den Maßnahmen, die im Einzelfall getroffen wurden:
- Grad 0: keine Nebenwirkungen
- Grad 1: geringe Nebenwirkungen
- Grad 2: Allgemeinbefinden verschlechtert, Chemotherapeutika müssen vermindert werden
- Grad 3: Unterbrechung der Chemotherapie notwendig
- Grad 4: stationäre Krankenhausbehandlung erforderlich
- Grad 5: Tod durch Chemotherapie
Jedoch sind unter Nebenwirkungen nicht nur die individuellen, sondern auch die systematischen Auswirkungen des Einsatzes von Zytostatika zu berücksichtigen: Die Giftwirkung endet nicht mit dem Tod des Menschen, sondern bleibt darüber hinaus bestehen. Der Umgang mit Leichnamen von Personen, die zu Lebzeiten mit Zytostatika behandelt worden sind, ist Gegenstand von Diskussionen, die Moral, Pietät, Verantwortung und Umweltschutz betreffen (Stichworte: Zwangs-Kremierung und Erdbestattungsverbot).
Spezielle Zytostatikagruppen
Alkylantien
Alkylantien (Alkylanzien) sind die ältesten Zytostatika. Sie können Alkylgruppen auf die DNA übertragen. Da die Alkylantien mit zwei oder mehr funktionellen Gruppen versehen sind, können sie zwei DNA-Stränge vernetzen und dadurch verhindern, dass diese während der Zellteilung korrekt verdoppelt werden. Die Wirkung beruht also auf einer Hemmung der DNA-Replikation. Alkylantien sind mutagen und karzinogen. Ihre Hauptnebenwirkungen sind Übelkeit, Anämie und Immunschwächung. Sie werden bei Lymphomen, Leukämie, Brust- und Lungenkrebs sowie bei Sarkomen noch oft eingesetzt. Besondere Bedeutung haben sie gegen bösartige Hirntumore.
- Stickstoff-Lost-Derivate
- Cyclophosphamid
- Ifosfamid
- Trofosfamid
- Melphalan
- Chlorambucil
- Akylsulfonate
- Busulfan
- Treosulfan
- Nitrosoharnstoffe
- Procarbazin und Dacarbazin
- Temozolomid
- Thiotepa
Platinanaloga
Der Komplex cis-[Pt(NH3)2Cl2] = Cisplatin und seine Verwandten gehören zu den wirksamsten Chemotherapeutika überhaupt. Sie verursachen ebenfalls Quervernetzungen der DNA durch kovalente Bindung des Platinatoms an zwei Nukleinbasen. Platine verursachen Übelkeit, Anämie, Nerven- und Nierenschäden. Ihr Haupteinsatzgebiet sind Hoden- Gebärmutter- und Eierstockkrebs sowie Tumoren der Halsregion. Ein neueres Platin-Analogon, Oxaliplatin, wird zurzeit bei Darmkrebs eingesetzt.
- Cisplatin
- Carboplatin
- Oxaliplatin
- Satraplatin
Interkalantien
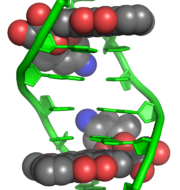 interkalierendes Doxorubicin
interkalierendes DoxorubicinInterkalantien binden nichtkovalent an die DNA und verhindern die Anbindung der Polymerasen, welche zur Replikation und Transkription der Erbsubstanz dienen. D. h. Zellteilung und Zellfunktion werden gestört. Die Substanzen werden wegen der geringen Rate an resistenten Tumoren sehr oft und bei fast allen soliden Tumoren eingesetzt; sie eignen sich auch als Mono-Therapie bei Patienten, die starkwirksame Kombinationen nicht vertragen. Übelkeit und Anämie, sowie verschiedene Organschäden sind ihre häufigsten Nebenwirkungen.
- Anthracycline
- Doxorubicin (Adriamycin)
- Daunorubicin
- Epirubicin
- Idarubicin
- Mitoxantron
- Amsacrin
- Doxifluridin
Antibiotika
Die Vertreter dieser Substanzgruppe mit antibakterieller und gleichzeitig zytostatischer Wirkung wurden aus Pilzen isoliert. Die Wirkmechanismen sind unterschiedlich, meist DNA-Vernetzung durch Interkalation oder Alkylierung. Es sind vorwiegend Peptide, daher können bei der Anwendung allergische Reaktionen auftreten. Weitere Nebenwirkungen sind Lungen- oder Leberschäden. In Protokollen gegen Hodenkrebs, Blasenkrebs und maligne Lymphome sind oft Antibiotika vertreten.
Mitosehemmer
Diese Stoffe binden an das Tubulin, ein Eiweißmakromolekül, welches zur Zellteilung (siehe Mitose) notwendig ist. Der Einsatz ist bei Lymphomen und Leukämien, seltener bei soliden Tumoren üblich. Ihre unangenehmste Nebenwirkung ist eine Schädigung des Nervensystems.
- Alkaloide der Rosafarbenen Catharanthe (Catharanthus roseus, frühere Bezeichnung Vinca rosea):
- Vinorelbin
- Vincristin (Oncovin)
- Vinblastin
- Vindesin
Taxane
Eine relativ neue Substanzgruppe, obwohl sie bereits in den 1960er Jahren am National Cancer Institute in den USA durch ein systematisches Screening von 35.000 Pflanzengattungen entdeckt wurde, und zwar in der Pazifischen Eibe (Taxus brevifolia). Erst seit sie synthetisch hergestellt werden können (1994), finden Taxane zunehmende Verbreitung bei Brust-, Prostata- und Lungenkrebs und beim Hautkrebs, oft als Monotherapie. Die Wirkung beruht auf der Bildung von anomalen Molekülen im Zellskelett, was die geordnete Zellteilung verhindert.
Topoisomerasehemmer
Die Topoisomerasen I und II sind Enzyme, welche gezielte, reversible Unterbrechungen im DNA-Strang herstellen. Die Hemmung bewirkt irreguläre, nicht behebbare DNA-Brüche und spontane Vernetzungen. Diese neue Substanzklasse ist vielversprechend bei soliden Tumoren, Lymphomen, Hirntumoren und kindlichen Tumoren. Ihre Neigung zur Knochenmarksdepression (Anämie) ist allerdings gefürchtet.
- Topoisomerase-I-Inhibitoren
- Camptothecin
- Topotecan
- Irinotecan
Antimetabolite
Antimetabolite werden als falsche Bausteine in die DNA oder RNA eingebaut oder verhindern den Einbau der korrekten Bausteine, und stören so die Zellteilung und den Stoffwechsel. Ihre Nebenwirkungen sind Übelkeit und Anämie, sowie Nierenschäden.
Darm- und Brustkrebs und viele andere solide Tumore, sowie Leukämie sind die Einsatzgebiete für Antimetaboliten. Man vermutet, dass die Empfindlichkeit der Zellen gegenüber Strahlung gesteigert wird. 5-Fluorouracil ist aus diesem Grund die wichtigste Substanz in der Radiochemotherapie (s.o.).
- Folsäureantagonist
- Pyrimidinanaloga
- Purinanaloga
- 6-Thioguanin
- Pentostatin
- Azathioprin
- 6-Mercaptopurin
- Fludarabin
- Cladribin
Andere Zytostatika
- L-Asparaginase, ein im Serum von Meerschweinchen entdecktes Enzym, welches die Aminosäure L-Asparagin abbaut. Manche Leukämiezellen können diese Aminosäure nicht herstellen. Die Toxizität gegenüber normalen Zellen ist sehr gering.
- Hydroxycarbamid (Hydroxyharnstoff, Hydroxyurea, Litalir®, Syrea®) hemmt das Enzym Ribonukleotid-Reduktase und dadurch die DNA-Synthese. Typische Anwendungsgebiete sind insbesondere myeloische Leukämien (vor allem bei Anzeichen einer Leukostase) und andere myeloproliferative Erkrankungen wie essentielle Thrombozythämie und Polycythaemia vera (rubra). Die Hauptnebenwirkung ist eine Knochenmarksdepression.
- Mitotane, ein Verwandter des Insektizids DDT mit spezifischer Wirksamkeit gegen den Stoffwechsel von Zellen – auch Tumorzellen – in der Nebenniere
- Amanitine hemmen die Transkription durch Blockade der RNA-Polymerase. Damit kann keine genetische Information mehr aus dem Zellkern in das Zellplasma gelangen, und die Proteinbiosynthese ist blockiert. Durch die mannigfaltigen Funktionen der Proteine sind viele Stellen des Organismus betroffen.
Literatur
Allgemeine Literatur
- W.J. Zeller, H. zur Hausen (Hrsg.): Onkologie. Ecomed, Landsberg 1995, Loseblattausgabe
Alkylantien
- Ulrich Meyer: Die Geschichte der Alkylanzien. Pharmazie in unserer Zeit 35(2), S. 104 - 109 (2006), ISSN 0048-3664
Metallkomplexe
- Wieland Voigt, Andrea Dietrich, Hans-Joachim Schmoll: Cisplatin und seine Analoga. Pharmazie in unserer Zeit 35(2), S. 134 - 143 (2006), ISSN 0048-3664
- Markus Galanski, Bernhard K. Keppler: Tumorhemmende Metallverbindungen. Pharmazie in unserer Zeit 35(2), S. 118 - 122 (2006), ISSN 0048-3664
Taxane
- Eckhard Leistner: Die Biologie der Taxane. Pharmazie in unserer Zeit 34(2), S. 98–103 (2005), ISSN 0048-3664
- Volker Bartsch: Wirkmechanismus der Taxane. Pharmazie in unserer Zeit 34(2), S. 104–108 (2005), ISSN 0048-366
Ethik
- Marlies Frast: Zu Staub oder Asche. Ist eine gesetzliche Kremationspflicht von Verstorbenen nach vorausgegangener Zytostatika-Therapie aus ethischer Sicht vertretbar?. Universität Zürich (2005), [1]
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
