- Β-Sitosterin
-
Strukturformel 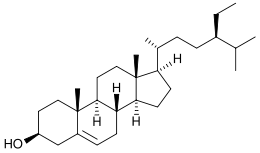
Allgemeines Name β-Sitosterin Andere Namen - 22,23-Dihydrostigmasterin
- (24R)-24-Ethyl-5-cholesten-3β-ol
- 3β-Stigmast-5-en-3-ol
- α-Dihydrofucosterin
- Nimbosterin
- α-Phytosterin
- Prostasal
- Quebrachol
- Rhamnol
- Cinchol
- Cupreol
Summenformel C29H50O CAS-Nummer 83-46-5 PubChem 86821 Kurzbeschreibung farblose Plättchen [1] Fertigpräparate - Azuprostat SANDOZ®
- Harzol®
- Sitosterin®
- Triastonal®
Verschreibungspflichtig: nein (Apothekenpflichtig) Eigenschaften Molare Masse 414,69 g•mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit - wenig löslich in Wasser [3]
- löslich in Essigsäure, Ethanol und Ether [3]
Sicherheitshinweise Gefahrstoffkennzeichnung [4] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. β-Sitosterin, auch β-Sitosterol, zählt zur Gruppe der Phytosterine, deren chemische Strukturen Ähnlichkeit mit der von Cholesterin aufweisen. Es ist ein weißer wachsartiger Stoff.
Inhaltsverzeichnis
Geschichte
Sitosterin wurde zuerst 1897 aus Weizenkeimöl von dem Gründer des Instituts für Medizinische Physiologie in Belgrad, Richard Burian isoliert.[5] Er nannte den mit Cholesterin isomeren Alkohol nach seiner Herkunft Sitosterin (engl. Sitosterol) (aus altgr. σῖτος, sitos, „Getreide“). Dieses Sitosterin erwies sich nach Arbeiten von Rudolph John Anderson als ein Gemisch mit mindestens fünf Komponenten (α-Sitosterin, β-Sitosterin, γ-Sitosterin, sowie Stigmasterin und Sitostanol). Anderson konnte β-Sitosterin zuerst 1926 aus Maiskeimöl und Weizenkeimöl rein isolieren.[6][7]
Spätere Untersuchungen ergaben, dass Andersons α-Sitosterin ebenfalls ein Gemisch aus drei Komponenten darstellt.[8] In den folgenden Jahren wurde β-Sitosterin dann auch in vielen anderen Pflanzenölen gefunden.[2]
Vorkommen
β-Sitosterin ist im Pflanzenreich weit verbreitet. Anfangs wurde es in Weizenkeimöl, Maiskeimöl (corn oil im Amerikanischen), Roggenkeimöl, Baumwollsamenöl, Tallöl, in Sojaöl und Calabarbohnen sowie in Cinchonawachs und -rinde gefunden (daher der Name Cinchol). Es kommt aber unter anderem auch in Pekannüssen, in der Sägepalme (Serenoa repens), in Avocados (Persea americana), Kürbissamen (Curcurbita pepo), Prunus africana (Pygeum africanum), Cashewnüssen, Reiskleie, Sanddorn und Bocksdorn- bzw. Gojifrüchten vor.
Die höchsten Konzentrationen an β-Sitosterin finden sich in folgenden Pflanzenteilen mit Angabe in parts per million[9]:- Cherimoya-Samen (Annona cherimola MILL.): 10000–14000 ppm
- Zweigriffliger Weißdorn-Blüten und -Blätter (Crataegus laevigata (POIR.) DC): 6500–7800 ppm in den Blüten; 5100–6200 ppm in den Blättern
- Echter Schwarzkümmel-Samen (Nigella sativa L.): 3218 ppm
- Gemeine Nachtkerzen-Samen (Oenothera biennis L.): 1186–2528 ppm
- Salbei-Blätter (Salvia officinalis L.): 5–2450 ppm
- Weiße Maulbeere (Morus alba L.): 2000 ppm in den Blättern
- Senna obtusifolia (L.) H.IRWIN & BARNEBY: 1000–2000 ppm in den Samen
- Buchweizen-Samen (Fagopyrum esculentum MOENCH.): 1880 ppm
- Basilikum-Blätter (Ocimum basilicum L.): 896–1705 ppm
- Mais (Zea mays L.): 1300 ppm in Maisgriffel, in Narbe/Stylus (Maisgriffel)
- Salbei-Stiel (Salvia officinalis L.): 1214 ppm
- Basilikum-Blüte (Ocimum basilicum L.): 1051 ppm
- Sanddorn-Samen (Hippophae rhamnoides L.): 550–970 ppm
- Sojabohne (Glycine max (L.) MERR.): 900 ppm in den Samen
- Süßholz-Wurzel (Glycyrrhiza glabra L.): 500 ppm in Radix Liquiritiae
- Basilikum-Wurzel (Ocimum basilicum L.): 408 ppm
- Duftveilchen (Viola odorata L.): 330 ppm in der Pflanze
- Basilikum-Sprossen (Ocimum basilicum L.): 230 ppm im Stiel des Keimlings
- Ashwaganda-Wurzel (Withania somnifera (L.) DUNAL): 200 ppm
- Sägepalme-Früchte, Sabalpalme (Serenoa repens (W. BARTRAM) SMALL): 189 ppm
β-Sitosterin-Gehalt in einigen Pflanzenölen[10] Quelle Konzentration in % typischer Gehalt in % Tallöl 10–20 18 Maiskeimöl 0,5–1,0 0,9 Maisfaseröl 10–20 12,5 Kürbissamenöl 0,2–0,3 0,25 Sägepalmenöl 0,1–0,3 0,2 Avocadoöl 0,4–0,9 0,5 Olivenöl 0,2–0,3 0,2 Reiskleieöl 0,5–0,8 0,75 Eigenschaften
β-Sitosterin ist chiral. Ein Diastereomer des β-Sitosterins mit (24S)-Konfiguration der Ethylgruppe in der Seitenkette wird als γ-Sitosterin bezeichnet. Der spezifische Drehwert von β-Sitosterin beträgt −37° (c = 2,0 in Chloroform bei 25 °C).[2]
Verwendung
β-Sitosterin wird einigen Margarinesorten in chemisch veränderter Form zugesetzt. Da es in Ölen und Fetten nur eingeschränkt löslich ist (2–3 %) und wegen der Doppelbindung oxidiert werden kann, wird das freie β-Sitosterin hydriert und mit Fettsäuren (üblicherweise dem Fettsäuregemisch aus Rapsöl) verestert. Das Produkt dieser Reaktion wird unter dem Namen Stanolester bis zu 8 % den Streichfetten beigemengt.[10]
Pharmakologische Wirkung
Die normale Aufnahme von β-Sitosterin durch die Nahrung beträgt ca. 250–300 mg pro Tag. Dabei werden im Magen-Darmtrakt ca. 5 % des aufgenommenen β-Sitosterins resorbiert.[10]
Allein oder in Kombination mit ähnlichen Phytosterinen vermag β-Sitosterin in höheren Dosen (1–3 g pro Tag) den Cholesterinspiegel des Blutes zu senken[10] und wird daher manchmal als Mittel gegen Hypercholesterinämie eingesetzt, da es die Cholesterinaufnahme hemmt.[2]
β-Sitosterin wird in Europa auch in der Pflanzenheilkunde in niedrigeren Dosierungen (mg-Bereich) zur symptomatischen Behandlung einer beginnenden Benignen Prostatahyperplasie (BPH) eingesetzt.
Auch zur Behandlung von Prostatakarzinom und Brustkrebs wird es verwendet. Die Wirkprinzipien sind noch weitgehend unbekannt, der Einsatz begründet sich hauptsächlich auf die Erfahrungsmedizin. Diskutiert werden hormonartige Effekte (estrogenartig) und die Hemmung der Prostaglandinsynthese.[11]
Eine kleinere Studie zeigte auch eine Hemmung der Glatzenbildung bei Männern in Zusammenhang mit Sägepalmenextrakt.[12]
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ a b c d The Merck Index, 12th edition, Whitehouse Station, New Jersey, USA: Merck & Co. 1996
- ↑ a b Robert C. Weast (Editor): CRC Handbook of Chemistry and Physics, 58th edition, CRC Press, Cleveland, Ohio, USA, 1977.
- ↑ Sicherheitsdatenblatt des Herstellers Roth; 25. Juni 2008.
- ↑ Burian, R.: Über Sitosterin. Ein Beitrag zur Kenntniss der Phytosterine. In: Monatshefte für Chemie. 1897, 18, 551.
- ↑ R.J. Anderson; R.L. Shriner: The Phytosterols of Corn Oil, Journal of the American Chemical Society 1926, 48, 2976–2986.
- ↑ R.J. Anderson; R.L. Shriner; G.O. Burr: The Phytosterols of Wheat Germ Oil, Journal of the American Chemical Society 1926, 48, 2987–2996.
- ↑ Everett S. Wallis; E. Fernholz: α-Sitosterol, Journal of the American Chemical Society 1936, 58, 2446–2448.
- ↑ Dr. Duke's Phytochemical and Ethnobotanical Databases, ars-grin.gov
- ↑ a b c d Laurence Eyres: Phytosterols and Other Functional Lipids in Food; abgerufen am 25. Juni 2008.
- ↑ www.heilpflanzen-suchmaschine.de.
- ↑ N. Prager; K. Bickett; N. French; G. Marcovici: A randomized, double-blind, placebo-controlled trial to determine the effectiveness of botanically derived inhibitors of 5-alpha-reductase in the treatment of androgenetic alopecia, Journal of alternative and complementary medicine (New York, N.Y.) 2002, 8, 143–152 doi:10.1089/107555302317371433
Wikimedia Foundation.
