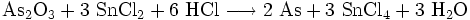- Bettendorfsche Reagenz
-
Strukturformel Keine Strukturformel vorhanden Allgemeines Name Zinn(II)-chlorid Andere Namen - Zinndichlorid
- Zinnchlorür
- Einfach-Chlorzinn
- Stannochlorid (Dihydrat)
Summenformel SnCl2 (wasserfrei)
SnCl2 · 2 H2O (Dihydrat)CAS-Nummer 7772-99-8 (wasserfrei)
10025-69-1 (Dihydrat)Kurzbeschreibung farblose Kristalle Eigenschaften Molare Masse 189,61 g·mol−1 (wasserfrei) Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 622–624 °C (wasserfrei)[1]
Löslichkeit gut löslich in Wasser und vielen organischen Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36/37/38-43 S: 24-26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Zinn(II)-chlorid (veraltet: Zinnchlorür) ist ein Chlorid des Zinns, das Zinnsalz der Salzsäure. Es bildet farblose oder grauweiße, fettig glänzende Kristalle.
Inhaltsverzeichnis
Darstellung
Wasserfreies Zinn(II)-chlorid erhält man durch Erhitzen von Zinn in Chlorwasserstoff:
Aus wässriger Lösung fällt das Dihydrat aus.
In Sodafabriken füllt man granuliertes Zinn in irdene Gefäße und leitet Salzsäuredämpfe aus den Sulfatöfen ein, worauf man die abgelassene Lösung von Zinn(II)-chlorid zur Kristallisation bringt. Auch aus Weißblechabfällen, die drei bis fünf Prozent Zinn enthalten, wird Zinn(II)-chlorid mit Salzsäuredämpfen gewonnen.
Zinn(II)-chlorid kommt als feste Salzmasse oder in Lösung mit überschüssiger Salzsäure in den Handel. Es ist farblos, schmeckt unangenehm metallisch, wird an der Luft feucht, schmilzt bei 40 °C, wird bei 100 °C völlig oder beinahe wasserfrei und bildet bei schnellem Erhitzen auf 100 °C Oxidchlorid, aus dem bei höherer Temperatur wasserfreies Zinn(II)-chlorid abdestilliert.
Es löst sich leicht in Alkohol und in wenig Wasser, gibt mit mehr Wasser ein saures Chlorid und unlösliches, weißes, basisches Zinn(II)-chlorid und nur bei Gegenwart von Salzsäure, Weinsäure oder Salmiak eine klare Lösung. Die Kristalle und die Lösung absorbieren an der Luft Sauerstoff unter Bildung von unlöslichem, weißem Oxichlorid, das in Gegenwart von Salzsäure und Zinn wieder reduziert wird.
Zinn(II)-chlorid reduziert Silber- und Quecksilbersalze zu den Metallen, reduziert Eisen(III) zu Eisen(II), auch Indigo etc.
Eigenschaften
In reinem Zustand schmilzt kristallines Zinn(II)-chlorid bei 247 °C. Das Zinn(II)-chlorid-dihydrat schmilzt bei 40 °C und verdampft bei höherer Temperatur unter Zersetzung. Durch Luftsauerstoff erfolgt in wässriger bzw. salzsaurer Lösung leicht die Oxidation zu Zinn(IV)-chlorid.
Zinnspäne lösen sich in warmer Salzsäure, und die Lösung gibt beim Verdampfen große, durchsichtige Kristalle von Zinn(II)-chlorid-dihydrat. Dieses Zinnsalz wird großtechnisch dargestellt, indem Zinn in Salzsäure gelöst wird, wobei das Metall stets im Überschuss vorhanden sein muss, da die Lösung bei Gegenwart von etwas granuliertem Zink bis 75 oder 78 °C verdampft und das Salz zur Kristallisation bringt.
Zinn(II)-chlorid fluoresziert blau unter UV-Licht.
Verwendung
Zinn(II)-chlorid wird im Labor als Reduktionsmittel verwendet. In der Galvanik dient es zur elektrolytischen Verzinnung.
Zinn(II)-chlorid dient in der chemischen Analyse, in der Färberei zur Reduktion des Indigos und von Eisen- und Manganoxid auf Zeugen, als Beizmittel, namentlich zum Färben mit Cochenille, zum Avivieren und Rosieren, auch zur Darstellung von Goldpurpur und Lackfarben, als Antichlor und zum Entfernen von Rostflecken aus Wäsche.
Zinn(II)-chlorid dient als Lösung mit konzentrierter Salzsäure unter dem Namen Bettendorfs Reagenz als Nachweismittel für Arsen und Quecksilber[2]. Dabei kommt es zu einer Braunfärbung der Lösung, da Zinn(II)-chlorid die Arsenverbindung reduziert und so elementares Arsen ausfällt. Die Reaktion wird Bettendorfsche Probe genannt.
In der Lebensmitteltechnik wird es als Antioxidationsmittel, Säuerungsmittel und Stabilisator eingesetzt, wobei es Verfärbungen bei weißen Gemüsekonserven (z.B. Spargel) verhindert. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 512 ausschließlich für Spargelkonserven in Gläsern oder Dosen mit einer Höchstmengenbeschränkung von 25 mg/kg für den Zinnanteil im Endprodukt zugelassen. Es gilt in den üblichen Mengen als gesundheitlich unbedenklich, in großen Mengen sind jedoch Magenreizungen möglich.[3]
Quellen
- ↑ a b c d e f Eintrag zu Zinn(II)-chlorid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 10.11.2007 (JavaScript erforderlich)
- ↑ http://www.panreac.com/new/esp/fds/Ale/X171552.htm
- ↑ http://www.zusatzstoffe-online.de/zusatzstoffe/214.e512_zinn_ii_chlorid.html
Wikimedia Foundation.


_chloride.jpg)