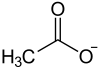
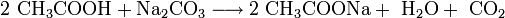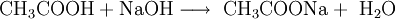- CH3COONa
-
Strukturformel 
Allgemeines Name Natriumacetat Andere Namen Natriumethanoat (nach IUPAC)
Summenformel C2H3NaO2 CAS-Nummer - 127-09-3 (wasserfrei)
- 6131-90-4 (Trihydrat)
Kurzbeschreibung weißes kristallines Salz Eigenschaften Molare Masse 82,03 g·mol–1 Aggregatzustand fest
Dichte 1,52 g·cm–3 (20 °C, wasserfrei)[1]
1,42 g·cm-3 (20 °C, Trihydrat)[1]Schmelzpunkt Siedepunkt nicht zutreffend
Löslichkeit gut in Wasser (365 g/l bei 20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.
Natriumacetat ist ein farbloses, schwach nach Essig riechendes Salz. Es ist das Natriumsalz der Essigsäure und entsteht beispielsweise bei der Reaktion von Natronlauge, Natriumcarbonat oder Natriumhydrogencarbonat mit Essigsäure. Gelegentlich wird Natriumacetat mit NaAc oder NaOAc abgekürzt, was zu Verwirrung führen kann, da Ac das Symbol für das Element Actinium ist.Inhaltsverzeichnis
Eigenschaften
Aus wässrigen Lösungen kristallisiert Natriumacetat mit 3 Mol Kristallwasser: Na(CH3COO) · 3 H2O.[2] Dieses Trihydrat bildet große, farblose Kristalle und ist gut wasserlöslich (612 g/l bei 20 °C) und löst sich ab 58 °C im eigenen Kristallwasser.[1] Bei höherer Temperatur (~120 °C) verdampft das Kristallwasser und es entsteht kristallwasserfreies Natriumacetat Na(CH3COO), manchmal auch NaAc (Schreibweise der Anorganik), "organisch korrekt" NaOAc geschrieben. Das wasserfreie Salz ist ebenfalls farblos und zieht Luftfeuchtigkeit an, es ist hygroskopisch und gut wasserlöslich (365 g/l bei 20 °C).[1] Wässrige Lösungen von Natriumacetat und Essigsäure bilden eine Pufferlösung. Das heißt der pH-Wert bleibt auch nach Zugabe von (kleineren Mengen) Säure oder Lauge nahezu konstant.[3]
Verwendung
Natriumacetat ist der Lebensmittelzusatzstoff E 262a. Er wird als Säureregulator und Konservierungsmittel für Obst und Gemüse in Dosen und Gläsern, Brot, Fisch in allen Variationen, Feinkostsalaten, Mayonnaisen und Salatsaucen verwendet.[4]
Aus übersättigter Natriumacetatlösung lassen sich zu Demonstrationsversuchen einfach Kristalle, die Eisbergen ähneln, herstellen. Hierfür werden Impfkristalle auf den Boden eines Becherglases gelegt und langsam mit einer übersättigten Natriumacetatlösung begossen. Es bilden sich sofort Kristalle und häufen sich zu einem eisbergähnlichen Turm auf.[5]
Das sogenannte "Instant-Ice" basiert auf demselben Prinzip. Man füllt ein (durchsichtiges) Gefäß mit der Lösung auf und berührt mit der Fingerspitze die Oberfläche der Lösung. Diese kristallisiert sofort aus und wird fest wie Eis. (Die Fingerspitze ersetzt hier den Impfkristall)
Die Reaktion zu Natriumacetat ist stark exotherm, denn bei der Auskristallisation wird viel Energie in Form von Wärme frei. Sie wird in Wärmekissen genutzt, wobei das Trihydrat in regenerierbaren Handwärmern als Latentwärmespeicher dient.[2]
Herstellung
Im Labormaßstab kann es z. B. durch Reaktion von Natriumcarbonat (Soda) und Essigsäure gewonnen werden:
Ebenso z. B. durch Neutralisation von Natronlauge mit Ethan(Essig-)säure:
Quellen
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 127-09-3 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 20.1.2008 (JavaScript erforderlich)
- ↑ a b Skript Universität Freiburg
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 76–77.
- ↑ Enius.de
- ↑ Vorlesung Universität Erlangen
Wikimedia Foundation.