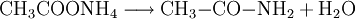- CH3COONH4
-
Strukturformel 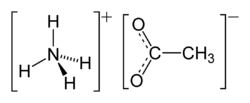
Allgemeines Name Ammoniumacetat Summenformel C2H7NO2 CAS-Nummer 631-61-8 Eigenschaften Molare Masse 77,08 g·mol−1 Aggregatzustand fest
Dichte 1,17 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung ab 90 °C
Löslichkeit sehr gut in Wasser (1480 g·l−1 bei 20 °C)[1]
gut in AlkoholSicherheitshinweise Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK 1 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumacetat, CH3COONH4, ist das Ammoniumsalz der Essigsäure. Es bildet farblose, schwach nach Essigsäure riechende Kristalle, die sich sehr gut in Wasser und gut in Ethanol lösen. Im festen Zustand bildet es eine hygroskopische Masse, die in Lösung neutral reagiert.
Inhaltsverzeichnis
Synthese
Ammoniumacetat lässt sich durch Umsetzung von Ammoniumcarbonat oder Ammoniak mit Eisessig gewinnen.
Verwendung
Verwendung findet das Ammoniumacetat in der Färberei, bei der Fleischkonservierung und in der biochemischen Laborarbeit. Im Labor wird es zur Herstellung von Pufferlösungen zur Stabilisierung des pH-Werts verwendet. Die Dissoziationskonstanten von Ammoniak und Essigsäure in Wasser sind nahezu identisch; Lösungen von Ammoniumacetat haben deshalb relativ unabhängig von der Konzentration einen pH-Wert von 7,0[2]. In der Mikroskopie wird es in Mischung mit Gummi arabicum als Einschlussmittel zur Herstellung von Dauerpräparaten eingesetzt.
In der Gentechnik wird die DNA manchmal mit Hilfe von Ammoniumacetat ausgefällt. Im Gegensatz zu Natriumacetat werden so keine Oligonukleotide und keine freien dNTPs mitgefällt, so dass auf diese Art gefällte DNA für die Transfektion von Säugerzellen besser geeignet ist. Sie ist allerdings nicht geeignet, wenn später Kinasen verwendet werden sollen.
Reaktionen
Beim Erhitzen zerfällt Ammoniumacetat unter Wasserabspaltung zu Acetamid.
Quellen
- ↑ a b c d e Eintrag zu CAS-Nr. 631-61-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 31.12.2007 (JavaScript erforderlich)
- ↑ R. J. Williams, C. M. Lyman J. Am. Chem. Soc.; 1932; 54(5) 1911 - 1912; A Neutral BufTered Standard for Hydrogen Ion Work and Accurate Titrations Which Can be Prepared in One Minute;
Wikimedia Foundation.