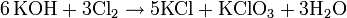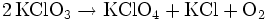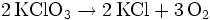- Chlorsaures Kali
-
Strukturformel 
Allgemeines Name Kaliumchlorat Andere Namen - Chlorsaures Kali
- Kalium chloricum
Summenformel KClO3 CAS-Nummer 3811-04-9 Kurzbeschreibung weißes kristallines Pulver Eigenschaften Molare Masse 122,55 g·mol−1 Aggregatzustand fest
Dichte 2,32 g·cm−3[1]
Schmelzpunkt Siedepunkt Zersetzung bei 400 °C[1]
Löslichkeit Löslichkeit in Wasser bei 20 °C: 73 g/l[1], gut in warmen Wasser (555 g/l bei 100 °C[1]), unlöslich in Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Brand-
förderndGesundheits-
schädlichUmwelt-
gefährlich(O) (Xn) (N) R- und S-Sätze R: 9-20/22-51/53 S: (2)-13-16-27-61 WGK 2[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumchlorat (Summenformel KClO3) ist das Kaliumsalz der Chlorsäure (HClO3).
Kaliumchlorat ist ein weißes beständiges Salz, das sich in Wasser unter Bildung einer farblosen Lösung löst. Die Verbindung besitzt stark oxidierende Eigenschaften und wird unter anderem zur Herstellung von Streichhölzern verwendet.
Inhaltsverzeichnis
Herstellung
Die Gewinnung von Kaliumchlorat erfolgt durch Elektrolyse einer Natriumchlorid-Lösung und der nachfolgenden Fällung des entstandenen Natriumchlorats mit Kaliumchlorid. Dabei werden die Elektroden (Kathode: Stahl; Anode: aktiviertes Titan) nicht wie bei der Herstellung von Natriumhydroxid durch eine Membran voneinander getrennt, sondern eng aneinander gelegt. Dadurch kommt das intermediär bei der Elektrolyse gebildete Chlor in Kontakt mit der Natronlauge und bildet Natriumhypochlorit (2 NaOH + Cl2 → NaCl + NaOCl + H2O), welches bei höheren Temperaturen zu Chlorid und Chlorat disproportioniert (3 NaOCl → 2 NaCl + NaClO3).
Bei der Elektrolyse einer Kaliumchlorid-Lösung entsteht das Kaliumchlorat auf direktem Weg.
Früher wurde Kaliumchlorat durch Einleiten von Chlor in Kaliumhydroxid-Lösung dargestellt. Es bildeten sich zunächst Kaliumchlorid und Kaliumhypochlorit zu gleichen Teilen. In der bei der Reaktion entstehenden Wärme disproportioniert das Hypochlorit zu zwei Teilen Kaliumchlorid und einem Teil Kaliumchlorat. Bei dieser Reaktion treten im Grunde genommen die gleichen Reaktionen auf wie bei der oben genannten Variante, allerdings werden teurere Edukte (Chlorgas und Kaliumhydroxid), aber kein Strom benötigt. Die Gesamtreaktionsgleichung lautet:
Daraus wird ersichtlich, dass die Chloratausbeute nur ein Sechstel des eingesetzten Chlors ist.
Eigenschaften
Kaliumchlorat ist in kaltem Wasser schlecht, in warmem besser löslich und im Gegensatz zu Natriumchlorat nicht hygroskopisch. Es bildet beim Auskristallisieren aus wässriger Lösung strahlend glänzende und schillernde flache Kristalle. Wird es jedoch zum Beispiel durch Zugabe eines Kaliumsalzes zu einer Natriumchloratlösung ausgefällt, so entsteht es als höchst feines, weitaus weniger glänzendes Pulver. Es ist ein Oxidationsmittel, durch Erhitzen über den Schmelzpunkt disproportioniert es unter Sauerstoffentwicklung zu Kaliumperchlorat und Kaliumchlorid:
Beim Erhitzen über 550 °C zerfällt es komplett in Sauerstoff und Kaliumchlorid. Diese Zersetzung findet bei Zugabe von Mangandioxid (Braunstein) als Katalysator schon bei 150 bis 200 °C statt.
Sehr brisant sind Mischungen mit oxidierbaren Stoffen wie beispielsweise Schwefel, Phosphor, Iod und Kohlenstoff, die schon durch Reibung, Stoß oder Schlag explodieren können. Die brisantesten Mischungen sind mit rotem Phosphor und gelten bei feinster Vermischung als dynamitähnlich (Armstrongsche Mischung). In der Technik werden Mengen im einstelligen Milligrammbereich daher nur nass vermischt und mit Bindemittel für Knallkorken und Zündblättchen verwendet. Die bei Vorlesungsversuchen angewendete Mischung der trockenen Komponenten mittels Vogelfeder ist zu gefährlich und unnötig, da nach A. Stettbacher (Spreng- und Schießstoffe, Zürich 1948) in 96-prozentigem Ethanol die Mischung gefahrlos erfolgen kann und erst nach Verdunstung des Alkohols bei Druck Explosion erfolgt. Diese tritt auch bei Mischungen des Chlorats mit organischen Stoffen, z. B. Holzmehl oder Petroleum nach Reibung, Schlag oder Initialzündung ein. Hierdurch ist es schon oft zu Unfällen gekommen.
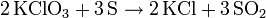
- Kaliumchlorat reagiert mit Schwefel zu Kaliumchlorid und Schwefeldioxid.
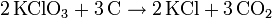
- Die Reaktion von Kaliumchlorat und Kohlenstoff ergibt Kaliumchlorid und Kohlenstoffdioxid.
Verwendung
Kaliumchlorat wird im Labor zur Sauerstoffgewinnung eingesetzt. Man verwendet es zur Herstellung von Streichhölzern, Leuchtmunition sowie Feuerwerkskörpern.
Ebenfalls verwendet man es zur Produktion von Sprengstoffen („Chloratit“ enthält z. B. etwa 90 % Kaliumchlorat, 10 % organische Kohlenwasserstoffe und einen Zusatz von Holzmehl). Diese reibungsempfindlichen Mischungen sind weitgehend durch handhabungssichere Explosivstoffe verdrängt worden.
Nicht ungefährlich war die Verwendung für „Knallerbsen“, wo ein Gemisch aus Kaliumchlorat und Phosphor zusammen mit Gummi arabicum zu Kügelchen geformt und danach getrocknet wurde.
Kaliumchlorat ist Bestandteil des „Holländischen Bades“, einer Ätzflüssigkeit für Kupferplatten aus 88 % Wasser, 10 % konz.Salzsäure und 2 % Kaliumchlorat, die für die Herstellung von Radierungen verwendet wird.
Es ist ein starkes Blut- und Nierengift (> 1 g). Zudem wirkt es antiseptisch und kam deshalb bei Gurgel- und Mundwässern zum Einsatz. Es gibt allerdings nur noch wenige Gurgelmittel, die Kaliumchlorat enthalten, da es aufgrund seiner Toxizität nur noch beschränkt eingesetzt werden darf. Die antiseptische Wirkung wird heute meist skeptisch beurteilt und sogar angezweifelt.
Quellen
- ↑ a b c d e f Eintrag zu Kaliumchlorat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 24.8.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 3811-04-9 im European chemical Substances Information System ESIS
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.