- Cyanwasserstoffsäure
-
Strukturformel 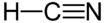
Allgemeines Name Cyanwasserstoff Andere Namen - Ameisensäurenitril
- Blausäure
- Cyanwasserstoffsäure
- Formonitril
- Hydrogencyanid
- Zyklon [1]
Summenformel HCN CAS-Nummer 74-90-8 Kurzbeschreibung nach Bittermandeln riechende Flüssigkeit Eigenschaften Molare Masse 27,03 g·mol–1 Aggregatzustand flüssig
Dichte 0,69 g·cm–3 [1]
Schmelzpunkt −13 °C [1]
Siedepunkt 26 °C [1]
Dampfdruck 0,816 bar (20 °C) [1]
Löslichkeit mit Wasser vollständig mischbar [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 


Hoch-
entzündlichSehr giftig Umwelt-
gefährlich(F+) (T+) (N) R- und S-Sätze R: 12-26-50/53 S: (1/2)-7/9-16-36/37-38-45-60-61 MAK 1,9 ml·m–3, bzw. 2,1 mg·m–3 [1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cyanwasserstoff (Blausäure), das Nitril der Ameisensäure, ist eine farblose bis leicht gelbliche, brennbare, flüchtige und wasserlösliche Flüssigkeit mit einem charakteristischen, unangenehmen Geruch nach Bittermandeln. Die Bezeichnung Blausäure rührt von der Gewinnung aus Eisenhexacyanoferrat (Berliner Blau) her, einem lichtechten tiefblauen Pigment. „Blausäure“ ist auch der Titel eines Kriminalromanes von Agatha Christie. Die Originalausgabe erschien 1945 unter dem Titel „Sparkling Cyanide“.
Inhaltsverzeichnis
Eigenschaften
Blausäure ist in Wasser eine sehr schwache Säure, die schon von Kohlensäure aus ihren Salzen, den Cyaniden, getrieben wird und nur zu einem kleinen Anteil dissoziert:
Ihr pKs-Wert wird, je nach Quelle, mit 9,04 - 9,31 angegeben. Blausäure ist hoch entzündlich, Gemische mit Luft sind im Bereich von 5,4–46,6 Vol.-% explosiv. Da Blausäure zudem mit Wasser in jedem Verhältnis mischbar ist, besteht bei Bränden die Gefahr einer Kontamination des Grundwassers, daher sollte gegebenenfalls ein kontrolliertes Abbrennen in Betracht gezogen werden.
Reine wasserfreie Blausäure kann spontan irreversibel polymerisieren. Diese Reaktion ist stark exotherm und wird durch geringe Mengen an Base initiiert, es entsteht dabei ein braunes Polymer.
Nachweis
- Ein klassisches Verfahren ist der Nachweis über die Cyanid-Ionen: Zu einer alkalischen Lösung wird im Unterschuss Eisen(II)-sulfat-Lösung zugegeben. Sind Cyanid-Ionen vorhanden, bildet sich nach dem Ansäuern Berliner Blau. Vorsicht: Es entweicht Blausäure!
- Bei Zugabe von Quecksilber(II)-chlorid entsteht Chlorwasserstoff-Gas. Dieses kann durch einen Säureindikator nachgewiesen werden.
Giftwirkungen
Blausäure ist sehr giftig, schon 1–2 mg Blausäure pro kg Körpergewicht wirken tödlich. Die Aufnahme kann, neben der direkten Einnahme, auch über die Atemwege und die Haut erfolgen. Letzteres wird durch Schweiß begünstigt, da Blausäure eine hohe Wasserlöslichkeit besitzt.
Die primäre Giftwirkung besteht in der Blockade der Sauerstoff-Bindungsstelle durch eine irreversible Bindung des Cyanids an den nur in sehr geringer Konzentration vorliegenden Häm a3/Cub-Komplex in der Cytochrom c Oxidase der Atmungskette in den Mitochondrien der Zelle. Durch die Inaktivierung dieses Enzyms kommt die Zellatmung zum Erliegen, die Zelle kann den Sauerstoff nicht mehr zur Energiegewinnung verwerten und es kommt damit zur sog. „inneren Erstickung“.
Die Bindung des Cyanids an Eisen(II)-Ionen ist vergleichsweise schwach. Die Inaktivierung des Hämoglobins spielt daher bei Vergiftungen eine untergeordnete Rolle.
Im Gegensatz zur landläufigen Meinung ist eine hellrote Färbung der Haut ein typisches Anzeichen einer Cyanidvergiftung: Das venöse Blut ist noch mit Sauerstoff angereichert, da der Sauerstoff von den Zellen nicht verwertet werden konnte. Aus gleichem Grund finden sich nach dem Tod durch Blausäure bei dem Toten leuchtend rote Leichenflecke (Livores), welche neben dem genannten Bittermandelgeruch ein wichtiges Indiz für einen unnatürlichen Tod sind. Bei einer Vergiftung mit sehr hohen Konzentrationen kommt es in Sekunden zur Hyperventilation, Atemstillstand, Bewusstlosigkeit und innerhalb von wenigen Minuten zum Herzstillstand. Eine hellrote Färbung der Haut bleibt in diesen Fällen oft aus.
Vergiftungssymptome
Symptome für eine Vergiftung sind unter anderem:
- Atemnot
- Bittermandelgeruch der Ausatemluft
- Kopfschmerzen
- Schwindel
- Erbrechen
- Krämpfe
- Ohnmacht
- rosige Hautfarbe
Genetische Wahrnehmungseinschränkung
Mehr als ein Viertel der Bevölkerung kann den Geruch von Blausäure nicht wahrnehmen, häufig wird die Wahrnehmung durch Lähmung der Geruchsnervenzellen verhindert.[5][6][7] Es müssen daher besondere Sicherheitsmaßnahmen beim Umgang mit Blausäure getroffen werden. Das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit berücksichtigt dies bei einer Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung.[8]
Antidot (Gegengift)
Bei Cyanid-Vergiftungen wird zunächst 4-Dimethylaminophenol (4-DMAP) als Antidot eingesetzt. Dieses wandelt Fe(II) in Fe(III) um, was zu einer Methämoglobin-Bildung führt. Das Methämoglobin bindet die Cyanidionen. Gemessen am gesamten Hämoglobin genügt schon eine geringe Menge an Methämoglobin, um einen großen Teil des Cyanids zu binden. Die Wirksamkeit dieses Gegenmittels hängt allerdings von der Hämoglobinkonzentration im Blut ab.
Bei Brandgasinhalation muss unbedingt beachtet werden, dass durch eine gleichzeitig vorliegende Kohlenmonoxidvergiftung größere Mengen Hämoglobin bereits gebunden sind und keinen Sauerstoff mehr transportieren können. Dies birgt bei der Behandlung, die bis zu einem Drittel des Hämoglobins umwandelt, die große Gefahr einer tödlichen Hypoxie.
Speziell für diese Fälle wird Hydroxycobalamin verwendet, welches unter dem Handelsnamen Cyanokit® in der EU seit 29. Nov 2007 zugelassen ist. Für dieses Antidot bestand bisher keine offizielle Zulassung in Deutschland, es wurde aber in einzelnen Regionen versuchsweise verwendet (etwa Berufsfeuerwehr München). Zu beachten ist hier jedoch, dass eine Lebensrettung nur bei 100%ig nüchternem Zustand (auch kein Restalkohol im Blut) Chancen auf Erfolg verspricht. Die Wirkung des Hydroxycobalamin besteht darin, dass es mit Cyanidionen starke Komplexe eingeht, und somit das Cyanid bindet.
Da viele Nahrungsmittel Cyanwasserstoff in geringen Konzentrationen enthalten, besitzt der Mensch das Enzym Rhodanase, welches Blausäure in den ungefährlichen Stoff Rhodanid umwandelt.
Als weitere Maßnahme könnte Isoamylnitrit zur Inhalation verabreicht werden, welches ebenfalls eine Methämoglobinbildung bewirkt; diese Maßnahme sollte wegen der Gefahr eines starken Blutdruckabfalls allerdings nur mit Vorsicht angewandt werden. In Deutschland befindet sich kein Präparat mit diesem Wirkstoff auf dem Markt; andere NO-Donatoren wie Glyceroltrinitrat bewirken nur eine sehr geringe Methämoglobinbildung und sind nicht als Antidot geeignet.
Natürliches Vorkommen
Die Kerne einiger Steinobstfrüchte (Mandel, insbesondere Bittermandel, Aprikose, Pfirsich, Kirsche) und anderer Rosengewächse enthalten geringe Mengen an Blausäure, diese dient vermutlich als Fraßschutz der Samen. Die in den Tropen vielfach als Nahrungsmittel genutzte Knolle des Maniok enthält ebenfalls als cyanogenes Glykosid gebundene Blausäure, die durch die Verarbeitung vor dem Verzehr der Pflanze entfernt wird. Weitere wichtige Nahrungsmittel mit toxikologisch relevanten Blausäuregehalten sind Yamswurzel, Süßkartoffel, Zuckerhirse, Bambus, Leinsamen und Limabohne. Unreife Bambussprossen, die in östlichen Ländern als Delikatesse gelten, enthalten hohe Blausäuregehalte, Vergiftungsfälle sind bekannt. Durch Zubereitung (intensives Kochen) wird die Blausäure von den Glykosiden abgespalten und in die Luft abgegeben.
Cyanogene Pflanzen sind weit verbreitet unter den höheren Pflanzen und können bei Verletzung des Pflanzengewebes durch Pflanzenfresser HCN aus cyanogenen Glykosiden mittels des Enzyms Hydroxynitrillyase freisetzen. Dabei handelt es sich natürlich um Giftpflanzen. Einige Beispiele für cyanogene Pflanzen sind der tropische Goldtüpfelfarn (Phlebodium aureum), ein Mitglied der Tüpfelfarngewächse, oder der brasilianische Gummibaum (Hevea brasiliensis). Einer der bekanntesten Stoffe, die Blausäure abspalten und in den Pflanzen vorkommen (Aprikosenkerne) ist Amygdalin.
Verwendung
Herstellung
Für die Herstellung von Blausäure sind folgende Verfahren von Bedeutung:
- Bei der Ammonoxidation von Methan (Andrussow-Verfahren) wird ein Gemisch aus Ammoniak und Methan bei rund 1200 °C an einem Platinnetz als Katalysator oxidiert.
- Bei der Ammondehydrierung von Methan (Degussa-BMA-Verfahren) werden Ammoniak und Methan mit Hilfe eines Katalysators zu Blausäure und Wasserstoff umgesetzt.
- Bei der Formamid-Spaltung (BASF-Verfahren) wird Formamid verdampft und stark erhitzt. Formamid spaltet sich dabei in Blausäure und Wasser.
- Von historischer Bedeutung ist außerdem die Thermolyse von Kaliumhexacyanoferrat (III) (Erlenmeyer-Verfahren).
In der Regel wird die Blausäure am Ort ihrer Herstellung sofort weiterverarbeitet, damit ein Transport dieses Gefahrstoffes nach Möglichkeit vermieden wird.
Hinrichtungen/Morde
- Die tödliche Wirkung der Blausäure wurde in den nationalsozialistischen Vernichtungslagern Majdanek und Auschwitz Birkenau benutzt, um Menschen in großer Zahl zu ermorden. Die Blausäurekonzentrationen sind je nach Entfernung zur Einwurfstelle unterschiedlich, lagen jedoch immer über 300 ppm. (Vergleiche Zyklon B, Gaskammer, Holocaust).
- Einige NS-Politiker sowie führende Angehörige der Wehrmacht entzogen sich der Verantwortung für ihr Handeln im 3. Reich durch Suizid mit Zyankali, aus dem im Magen Blausäure freigesetzt wird.
- In einigen Staaten der USA wurde Blausäuregas bis 1999 zur Vollstreckung der Todesstrafe in der Gaskammer eingesetzt; heute ist diese Hinrichtungsmethode dort nur noch zulässig, wenn die Giftspritze aus anderen Gründen nicht eingesetzt werden kann.
Kampfmittel
Als Giftgas wurde Blausäure erstmals durch die französische Armee am 1. Juli 1916 eingesetzt. Dieser Einsatz blieb nicht nur wegen neuartiger Filter in den Gasmasken der deutschen Gegner wirkungslos. Die Brauchbarkeit von Blausäuregas als Kampfstoff erwies sich als mangelhaft, weil sich das Gas sehr rasch verflüchtigte. Nach diesem Misserfolg wurde Blausäuregas als Kampfmittel nicht weiter verwendet. Bei modernen chemischen Kampfstoffen kann Blausäure jedoch als sogenannter Maskenbrecher hinzugefügt sein, um die Resorptionsfähigkeit des Filters übermäßig schnell zunichte zu machen und so dem eigentlichen Kampfstoff zur Wirkung zu verhelfen.
Industrielle Verwendung
Blausäure wird in vielen Prozessen in der Industrie und im Bergbau eingesetzt, beispielsweise für die Herstellung von Chlorcyan, Cyanurchlorid, Aminosäuren (besonders Methionin), Natriumcyanid und vieler weiterer Derivate sowie zum Auslaugen von Gold:
Die Gold-Lösung wird dann mit Zink reduziert. Der Cyanido-Komplex kann auch durch zugesetzte Kokosnußschalen-Aktivkohle absorptiv gebunden werden. Aus der so mit dem Cyanidokomplex beladenen Aktivkohle kann das Gold als nach dem Verbrennen des organischen Anteils als „Asche“ gewonnen werden. In moderneren Anlagen wird der Cyanido-Komplex aus der abgetrennten beladenen Aktivkohle durch Eluieren mit heißer Natriumcyanid-Lösung in konzentrierter Form gewonnen (wegen der besseren Handhabung wird hierbei nicht flüssige Blausäure, sondern eine Natriumcyanid-Lösung eingesetzt). Dieses Verfahren führt, wie auch das alternativ eingesetzte Quecksilber-Amalgamverfahren, zu den oft katastrophalen Gewässervergiftungen in den Goldfördergebieten der Dritten Welt.
Blausäure wird in großen Mengen zur Herstellung von Adiponitril und Acetoncyanhydrin, beides Zwischenprodukte der Kunststoffproduktion, verwendet. Bei der Adiponitril Herstellung wird Blausäure mittels eines Nickel-Katalysators an 1,3-Butadien addiert (Hydrocyanierung). Zur Acetoncyanhydrinherstellung wird Blausäure katalytisch an Aceton addiert. Aus Blausäure werden im industriellen Maßstab in mehrstufigen Verfahren auch die α-Aminosäure DL-Methionin (Verwendung in der Futtermittel-Supplementierung) und der Heterocyclus Cyanurchlorid hergestellt. Aus Cyanurchlorid werden Pflanzenschutzmittel und andere Derivate synthetisiert.
In Abfall- und Nebenprodukten
Blausäure wird bei falschen Bedienschritten in der Galvanik frei.
Beim Verbrennen stickstoffhaltiger Polymere (Kunststoffe) kann in erheblichem Umfang Blausäure entstehen. Auch beim Rauchen von Tabak entsteht etwas Blausäure. Ebenso setzt Esbit bei der Verbrennung geringe Mengen Blausäure frei.
Unfälle im Umgang mit Blausäure
- 1920, Schweden, Stockholm:
Der schwedische Schriftsteller und Dichter Dan Andersson stirbt zusammen mit einem Handlungsreisenden in einem Hotel an einer Blausäurevergiftung. Hotelpersonal hatte vorher die Zimmer begast und danach nicht ausreichend gelüftet. Blausäure wurde häufig als Schädlingsbekämpfungsmittel eingesetzt. - 1947, USA, Los Angeles:
Während der Begasung eines Holzhauses zur Termiten-Bekämpfung explodierte das hermetisch abgeriegelte Gebäude in Folge eines Zündfunkens bei hoher Blausäure-Konzentration. - 1995, Kroatien, Urlaubsort Lovran bei Rijeka:
Während des Versuches, eine Kirche von Holzwürmern zu befreien, trat ein Teil des Gases wegen unsachgemäßer Versiegelung des Gebäudes aus. Der gesamte Ortskern wurde daraufhin mitten in der Nacht evakuiert. - 1998, USA, Iowa:
Nachdem sich ein Schüler mit Kaliumcyanid getötet hatte, wurden neun Menschen von den aus seinem Körper austretenden Dämpfen krank. - 2000, Rumänien, Baia Mare:
100.000 Kubikmeter cyanidhaltige Lauge liefen aus einem Auffangbecken eines Bergwerks und vergifteten die Theiß bis Ungarn. - 2006, Tschechien, Nymburk:
Bei einem Chemieunfall in Tschechien gelangte eine größere Menge Cyanid in die Elbe. - 2007, Schweiz, Waldenburg:
Bei einem Produktionsprozess in der Basellandschafter Firma RERO AG wurden versehentlich Cyanid mit Schwefelsäure gemischt, wodurch Blausäure entstand. 15 Menschen mussten stationär behandelt werden. Laut Aussagen der örtlichen Behörden verblieb der Stoff im Betriebsgebäude, es gelangte keine Blausäure in die Atmosphäre.
Quellen
- ↑ a b c d e f g Eintrag zu Cyanwasserstoff in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 2. September 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 74-90-8 im European chemical Substances Information System ESIS
- ↑ a b Cyanwasserstoff bei ChemIDplus
- ↑ Department of Health: Hydrogen Cyanide. Version 1.2 vom 4. Februar 2004.
- ↑ Chemie im Alltag: Tödlicher Giftanschlag auf BASF Mitarbeiter, 2006
- ↑ Schadstoff-Glossar: Cyanwasserstoff beim Umweltbundesamt Baden-Württemberg
- ↑ Online Mendelian Inheritance in Man Cyanide, inability to smell, National Center for Biotechnology (NCBI)
- ↑ Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit: Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung
Siehe auch
Weblinks
- www.doccheck.com: Blausäureintoxikation
- www.inchem.org: Hydrogen Cyanide and Cyanides: Human Health Aspects
- www.frot.co.nz: Cyanogenic Glycosides and Cyanide Toxicity
- www.ifp.tu-bs.de: Blausäure in Nahrungspflanzen – Eine Gefahr für Lebensmittel?
Wikimedia Foundation.

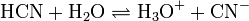
![\mathrm{4 \ Au + 8 \ HCN + O_2 + 4 \ OH^- \longrightarrow 4 \ [Au(CN)_2]^- + 6 \ H_2O}](/pictures/dewiki/100/dd10d69d2d8dd27b890360d3ea2aed09.png)