- Cyanwasserstoff
-
Strukturformel 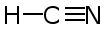
Allgemeines Name Cyanwasserstoff Andere Namen - Ameisensäurenitril
- Blausäure
- Cyanwasserstoffsäure
- Formonitril
- Hydrogencyanid
- Zyklon[1]
Summenformel HCN CAS-Nummer 74-90-8 PubChem 768 Kurzbeschreibung farblose, nach Bittermandeln riechende Flüssigkeit[1]
Eigenschaften Molare Masse 27,03 g·mol−1 Aggregatzustand flüssig
Dichte 0,69 g·cm−3[1]
Schmelzpunkt Siedepunkt 26 °C[1]
Dampfdruck pKs-Wert 9,40[2]
Löslichkeit mit Wasser vollständig mischbar[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 224-330-400-410 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3]. 


Hoch-
entzündlichSehr giftig Umwelt-
gefährlich(F+) (T+) (N) R- und S-Sätze R: 12-26-50/53 S: (1/2)-7/9-16-36/37-38-45-60-61 MAK 1,9 ml·m−3, bzw. 2,1 mg·m−3[1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cyanwasserstoff (Blausäure), das Nitril der Ameisensäure, ist eine farblose bis leicht gelbliche, brennbare, flüchtige und wasserlösliche Flüssigkeit. Die Bezeichnung Blausäure rührt von der Gewinnung aus Eisenhexacyanoferrat (Berliner Blau) her, einem lichtechten tiefblauen Pigment.
Blausäure ist hochgiftig. Ihre tödliche Wirkung wurde in der Geschichte verschiedentlich gegen Menschen eingesetzt und fand auch Eingang in die Literatur (Kriminalromane). Industriell wird Blausäure als Vorprodukt und Prozessstoff sowie zur Schädlingsbekämpfung eingesetzt.
Nach verbreiteter Auffassung geht von Blausäure ein charakteristischer Geruch nach Bittermandeln aus. Der tatsächliche Geruch der Substanz wird jedoch in der Literatur nicht einhellig so beschrieben und von manchen Menschen abweichend wahrgenommen, z. B. „dumpf“ oder „scharf“. Ein erheblicher Teil der Bevölkerung nimmt den Geruch von Blausäure überhaupt nicht wahr (siehe auch Handhabung).
Inhaltsverzeichnis
Eigenschaften
Blausäure ist in Wasser eine sehr schwache Säure, die schon von Kohlensäure aus ihren Salzen, den Cyaniden, getrieben wird und nur zu einem kleinen Anteil dissoziert:
Ihr pKs-Wert wird, je nach Quelle, mit 9,04–9,31 angegeben. Die Dissoziationskonstante beträgt 4,0·10-10.[6] Blausäure ist hochentzündlich, Gemische mit Luft sind im Bereich von 5,4–46,6 Vol.-% explosiv. Da Blausäure zudem mit Wasser in jedem Verhältnis mischbar ist, besteht beim Löschen von Bränden die Gefahr einer Kontamination des Grundwassers. Daher wird gegebenenfalls ein kontrolliertes Abbrennen in Betracht gezogen.
Blausäure kann in einer autokatalysierten Reaktion spontan polymerisieren oder gar in die Elemente zerfallen. Diese Reaktion ist stark exotherm und verläuft explosionsartig. Sie wird durch geringe Mengen an Basen initiiert und wird durch weitere Base, die sich dabei bildet, beschleunigt. Wasserhaltige Blausäure ist dabei instabiler als vollkommen wasserfreie. Es entsteht ein braunes Polymer. Aus diesem Grund wird Blausäure durch Zugabe geringer Mengen an Säuren, wie Phosphor- oder Schwefelsäure, stabilisiert. Die Säure neutralisiert die Basen und vermeidet eine Durchgehreaktion.
Nachweis
- Ein klassisches Verfahren ist der Nachweis über die Cyanid-Ionen: Zu einer alkalischen Lösung wird im Unterschuss Eisen(II)-sulfat-Lösung zugegeben. Sind Cyanid-Ionen vorhanden, bildet sich nach dem Ansäuern Berliner Blau. Gefahr!: Es entweicht Blausäure!
- Bei Zugabe von Quecksilber(II)-chlorid entsteht Chlorwasserstoff-Gas. Dieses kann durch einen Säureindikator nachgewiesen werden.
Giftwirkungen
Toxizität
Blausäure ist extrem giftig, schon 1–2 mg Blausäure pro kg Körpermasse wirken tödlich. Die Aufnahme kann, neben der direkten Einnahme, auch über die Atemwege und die Haut erfolgen. Letzteres wird durch Schweiß begünstigt, da Blausäure eine hohe Wasserlöslichkeit besitzt.
Die primäre Giftwirkung besteht in der Blockade der Sauerstoff-Bindungsstelle in der Atmungskette der Körperzellen. Dabei bindet sich das Cyanid irreversibel an das zentrale Eisen(III)-Ion des Häm-a3-Kofaktors in der Cytochrom-c-Oxidase in den Mitochondrien. Durch die Inaktivierung des Enzyms kommt die Zellatmung zum Erliegen, die Zelle kann den Sauerstoff nicht mehr zur Energiegewinnung verwerten, und es kommt damit zur sogenannten „inneren Erstickung“.
Die Bindung des Cyanids an Eisen(II)-Ionen ist vergleichsweise schwach. Die Inaktivierung des Hämoglobins spielt daher bei Vergiftungen eine untergeordnete Rolle.
Vergiftungssymptome
Eine hellrote Färbung der Haut ist ein typisches Anzeichen einer Cyanidvergiftung: Auch venöses Blut ist noch mit Sauerstoff angereichert, da der Sauerstoff von den Zellen nicht verwertet werden kann. Aus gleichem Grund finden sich nach einer Vergiftung durch Blausäure bei dem Toten leuchtend rote Leichenflecke (Livores), welche neben dem genannten Bittermandelgeruch ein wichtiges Indiz für einen unnatürlichen Tod ist. Bei einer Vergiftung mit sehr hohen Konzentrationen kommt es nach wenigen Sekunden zur Hyperventilation, Atemstillstand, Bewusstlosigkeit und innerhalb von wenigen Minuten zum Herzstillstand. Eine hellrote Färbung der Haut bleibt in diesen Fällen oft aus.
Symptome für eine Vergiftung sind unter anderem:
- Atemnot
- Bittermandelgeruch der Ausatemluft
- Kopfschmerzen
- Schwindel
- Erbrechen
- Krämpfe
- Ohnmacht
- rosige Hautfarbe
Antidot (Gegengift)
Bei Cyanid-Vergiftungen wird zunächst 4-Dimethylaminophenol (4-DMAP) als Antidot eingesetzt. Dieses wandelt Fe(II) in Fe(III) um, was zu einer Methämoglobin-Bildung führt. Das Methämoglobin bindet die Cyanidionen. Gemessen am gesamten Hämoglobin genügt schon eine geringe Menge an Methämoglobin, um einen großen Teil des Cyanids zu binden. Die Wirksamkeit dieses Gegenmittels hängt allerdings von der Hämoglobinkonzentration im Blut ab.
Bei Brandgasinhalation muss unbedingt beachtet werden, dass durch eine gleichzeitig vorliegende Kohlenmonoxidvergiftung größere Mengen Hämoglobin bereits gebunden sind und keinen Sauerstoff mehr transportieren können. Dies birgt bei der Behandlung, die bis zu einem Drittel des Hämoglobins umwandelt, die große Gefahr einer tödlichen Hypoxie.
Speziell für diese Fälle wird Hydroxycobalamin verwendet, welches unter dem Handelsnamen Cyanokit® in der EU seit 2007 zugelassen ist. Für dieses Antidot bestand bisher keine offizielle Zulassung in Deutschland, es wurde aber in einzelnen Regionen versuchsweise verwendet (etwa Berufsfeuerwehr München). Zu beachten ist hier jedoch, dass eine Lebensrettung nur bei 100%ig nüchternem Zustand (auch kein Restalkohol im Blut) Chancen auf Erfolg verspricht. Die Wirkung des Hydroxycobalamins besteht darin, dass es mit Cyanidionen starke Komplexe eingeht und somit das Cyanid bindet.
Der in vielen Nahrungsmitteln in geringen Konzentrationen enthaltene Cyanwasserstoff wird vom menschlichen Enzym Rhodanase in den ungefährlichen Stoff Rhodanid umwandelt.
Als weitere Maßnahme könnte Isoamylnitrit zur Inhalation verabreicht werden, welches ebenfalls eine Methämoglobinbildung bewirkt; diese Maßnahme sollte wegen der Gefahr eines starken Blutdruckabfalls allerdings nur mit Vorsicht angewandt werden. In Deutschland befindet sich kein Präparat mit diesem Wirkstoff auf dem Markt; andere NO-Donatoren wie Glyceroltrinitrat bewirken nur eine sehr geringe Methämoglobinbildung und sind nicht als Antidot geeignet.
Natürliches Vorkommen
Die Kerne einiger Steinobstfrüchte (Mandel, insbesondere Bittermandel, Aprikose, Pfirsich, Kirsche) und anderer Rosengewächse enthalten geringe Mengen an Blausäure, diese dient vermutlich als Fraßschutz der Samen. Die in den Tropen vielfach als Nahrungsmittel genutzte Knolle des Maniok enthält ebenfalls als cyanogenes Glykosid gebundene Blausäure, die durch die Verarbeitung vor dem Verzehr der Pflanze entfernt wird. Weitere wichtige Nahrungsmittel mit toxikologisch relevanten Blausäuregehalten sind Yamswurzel, Süßkartoffel, Zuckerhirse, Bambus, Leinsamen und Limabohne. Unreife Bambussprossen, die in östlichen Ländern als Delikatesse gelten, enthalten hohe Blausäuregehalte, Vergiftungsfälle sind bekannt. Durch Zubereitung (intensives Kochen) wird die Blausäure von den Glykosiden abgespalten und in die Luft abgegeben.
Cyanogene Giftpflanzen sind unter den höheren Pflanzen weit verbreitet und können bei Verletzung des Pflanzengewebes durch Pflanzenfresser HCN aus cyanogenen Glykosiden mittels des Enzyms Hydroxynitrillyase freisetzen. Einige Beispiele für cyanogene Pflanzen sind der tropische Goldtüpfelfarn (Phlebodium aureum), ein Mitglied der Tüpfelfarngewächse, oder der brasilianische Gummibaum (Hevea brasiliensis). Einer der bekanntesten Stoffe, die Blausäure abspalten und in den Pflanzen vorkommen (Aprikosenkerne), ist Amygdalin.
Herstellung
Industrielle Erzeugung
Für die Herstellung von Blausäure sind folgende Verfahren von Bedeutung:
- Bei der Ammonoxidation von Methan (Andrussow-Verfahren) wird ein Gemisch aus Ammoniak und Methan bei rund 1200 °C an einem Platinnetz als Katalysator oxidiert.
- Bei der Ammondehydrierung von Methan (Degussa-BMA-Verfahren) werden Ammoniak und Methan mit Hilfe eines Platinkatalysators zu Blausäure und Wasserstoff umgesetzt.
- Bei der Formamid-Spaltung (BASF-Verfahren) wird Formamid verdampft und stark erhitzt. Formamid spaltet dabei in Blausäure und Wasser.
- Als Nebenprodukt bei der Herstellung von Acrylnitril durch Ammoxidation von Propylen (Sohio-Verfahren). Die Menge an anfallender Blausäure kann dabei durch Zugabe von Methanol erhöht werden.
- Fluhomic- oder Shawinigan-Verfahren, bei dem Kohlenwasserstoffe und Ammoniak in einem Lichtbogen umgesetzt werden. Dieses Verfahren ist nur von untergeordneter Bedeutung und wird dort ausgeübt, wo elektrischer Strom preiswert ist.
- Von historischer Bedeutung ist außerdem die Thermolyse von Kaliumhexacyanoferrat (III) (Erlenmeyer-Verfahren).
Abfall- und Nebenprodukt
Blausäure wird bei fehlerhafter Handhabung von Prozessschritten in der Galvanik frei.
Beim Verbrennen stickstoffhaltiger Polymere (Kunststoffe) kann in erheblichem Umfang Blausäure entstehen.
Beim Rauchen von Tabak und bei der Verbrennung von Esbit werden geringe Mengen Blausäure freigesetzt.
Handhabung
Genetische Wahrnehmungseinschränkung
Mehr als ein Viertel der Bevölkerung kann den Geruch von Blausäure nicht wahrnehmen, häufig wird die Wahrnehmung durch Lähmung der Geruchsnervenzellen verhindert.[7][8][9] Es müssen daher besondere Sicherheitsmaßnahmen beim Umgang mit Blausäure getroffen werden. Das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit berücksichtigt dies bei Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung.[10]
Transport
Um den Transport dieses Gefahrstoffes zu vermeiden, wird Blausäure in der Regel sofort am Herstellungsort weiterverarbeitet.
Verwendung
Hinrichtungen/Morde
- Die tödliche Wirkung der Blausäure wurde in den nationalsozialistischen Vernichtungslagern Majdanek und Auschwitz-Birkenau benutzt, um Menschen in großer Zahl zu ermorden. Die Blausäurekonzentrationen waren je nach Entfernung zur Einwurfstelle unterschiedlich, lagen jedoch immer über 300 ppm. (Vergleiche Zyklon B, Gaskammer, Holocaust).
- Einige NS-Politiker sowie führende Angehörige der Wehrmacht entzogen sich der Verantwortung für ihr Handeln im Dritten Reich durch Suizid mit Zyankali, aus dem im Magen Blausäure freigesetzt wird.
- In einigen Staaten der USA wurde Blausäuregas bis 1999 zur Vollstreckung der Todesstrafe in der Gaskammer eingesetzt; heute ist diese Hinrichtungsmethode dort nur noch zulässig, wenn die Giftspritze aus anderen Gründen nicht eingesetzt werden kann.
Als Pestizid
Blausäure wird zur Bekämpfung von Ungeziefer eingesetzt. Hierzu wird ein Trägermaterial, z. B. Kieselgur, mit Blausäure getränkt und Riechstoffe zur Warnung zugefügt.
Kampfmittel
Als Giftgas wurde Blausäure erstmals durch die französische Armee am 1. Juli 1916 eingesetzt. Dieser Einsatz blieb nicht nur wegen neuartiger Filter in den Gasmasken der deutschen Gegner wirkungslos. Die Brauchbarkeit von Blausäuregas als Kampfstoff erwies sich als mangelhaft, weil sich das Gas sehr rasch verflüchtigte. Nach diesem Misserfolg wurde Blausäuregas als Kampfmittel nicht weiter verwendet. Bei modernen chemischen Kampfstoffen kann Blausäure jedoch als sogenannter Maskenbrecher hinzugefügt sein, um die Resorptionsfähigkeit des Filters übermäßig schnell zunichte zu machen und so dem eigentlichen Kampfstoff zur Wirkung zu verhelfen.
Industrielle Verwendung
Blausäure wird in vielen Prozessen in der Industrie und im Bergbau eingesetzt, beispielsweise für die Herstellung von Chlorcyan, Cyanurchlorid, Aminosäuren (besonders Methionin), Natriumcyanid und vieler weiterer Derivate sowie zum Auslaugen von Gold:
Die Gold-Lösung wird dann mit Zink reduziert. Der Cyanido-Komplex kann auch durch zugesetzte Kokosnussschalen-Aktivkohle absorptiv gebunden werden. Aus der so mit dem Cyanidokomplex beladenen Aktivkohle kann das Gold nach dem Verbrennen des organischen Anteils als „Asche“ gewonnen werden. In moderneren Anlagen wird der Cyanido-Komplex aus der abgetrennten beladenen Aktivkohle durch Eluieren mit heißer Natriumcyanid-Lösung in konzentrierter Form gewonnen (wegen der besseren Handhabung wird hierbei nicht flüssige Blausäure, sondern eine Natriumcyanid-Lösung eingesetzt). Dieses Verfahren führt, wie auch das alternativ nur noch sehr selten eingesetzte Quecksilber-Amalgamverfahren, zu den teilweise katastrophalen Gewässervergiftungen in den Goldfördergebieten der Dritten Welt.
Blausäure wird in großen Mengen zur Herstellung von Adiponitril und Acetoncyanhydrin, beides Zwischenprodukte der Kunststoffproduktion, verwendet. Bei der Adiponitrilherstellung wird Blausäure mittels eines Nickel-Katalysators an 1,3-Butadien addiert (Hydrocyanierung). Zur Acetoncyanhydrinherstellung wird Blausäure katalytisch an Aceton addiert. Aus Blausäure werden im industriellen Maßstab in mehrstufigen Verfahren auch die α-Aminosäure DL-Methionin (Verwendung in der Futtermittel-Supplementierung) und der Heterocyclus Cyanurchlorid hergestellt. Aus Cyanurchlorid werden Pflanzenschutzmittel und andere Derivate synthetisiert.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Cyanwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. September 2007 (JavaScript erforderlich).
- ↑ R. Williams: pKa Data, abgerufen am 12. Dezember 2010.
- ↑ a b Eintrag zu CAS-Nr. 74-90-8 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Cyanwasserstoff bei ChemIDplus.
- ↑ Department of Health: Hydrogen Cyanide. Version 1.2 vom 4. Februar 2004.
- ↑ Svirbely, W.J., Roth, J.F.; 1953.
- ↑ Chemie im Alltag: Tödlicher Giftanschlag auf BASF Mitarbeiter, 2006.
- ↑ Schadstoff-Glossar: Cyanwasserstoff beim Umweltbundesamt Baden-Württemberg.
- ↑ 'Cyanide, inability to smell' bei Online Mendelian Inheritance in Man.
- ↑ Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit: Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung.
Weblinks
- www.doccheck.com: Blausäureintoxikation
- www.inchem.org: Hydrogen Cyanide and Cyanides: Human Health Aspects
- www.frot.co.nz: Cyanogenic Glycosides and Cyanide Toxicity
- www.ifp.tu-bs.de: Blausäure in Nahrungspflanzen – Eine Gefahr für Lebensmittel?
Kategorien:- Feuergefährlicher Stoff
- Umweltgefährlicher Stoff
- Giftiger Stoff
- Stickstoffverbindung
- Kohlenstoffverbindung
- Wasserstoffverbindung
- Chemische Waffe
Wikimedia Foundation.



![\mathrm{4 \ Au + 8 \ HCN + O_2 + 4 \ OH^- \longrightarrow 4 \ [Au(CN)_2]^- + 6 \ H_2O}](1/dd10d69d2d8dd27b890360d3ea2aed09.png)