- Cyclotriborazan
-
Strukturformel 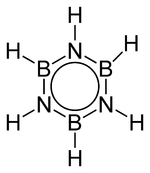
Allgemeines Name Borazin Andere Namen - Cyclotriborazan
- Borazol
Summenformel B3H6N3 CAS-Nummer 6569-51-3 PubChem 138768 Kurzbeschreibung klare, farblose Flüssigkeit mit einem aromatischen Geruch Eigenschaften Molare Masse 80,53 g/mol Aggregatzustand flüssig
Schmelzpunkt Siedepunkt 55 °C[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Borazin (Cyclotriborazan) ist eine cyclische Verbindung aus Bor, Stickstoff und Wasserstoff mit der Summenformel B3H6N3. Der Stickstoff trägt mit seinem freien Elektronenpaar dazu bei, dass diese Verbindung eine formale Ähnlichkeit zu Benzol besitzt, obwohl sie die Kriterien der Aromatizität nicht erfüllt. Nach einem Vorschlag von Nils Wiberg wird der Grundkörper dieser Verbindungen auch als „anorganisches Benzol“ bezeichnet. Daraus leitet sich auch die systematisch nicht zulässige Bezeichnung Borazol ab.
Die Bezeichnung Borazin/Borazine hat man in Anlehnung an die strukturell verwandten Alkine zudem der Stoffgruppe der Iminoborane verliehen.
Inhaltsverzeichnis
Geschichte
Borazin wurde zuerst von Alfred Stock am Anfang den 20. Jahrhunderts hergestellt. Er gewann es durch Erhitzen von Diboran und Ammoniak.
Gewinnung und Darstellung
Borazin lässt sich durch Erhitzen eines Gemisches aus Diboran und Ammoniak im Molverhältnis 1:2 auf 250–300 °C herstellen. Die Ausbeute dieser chemischen Reaktion liegt bei 50%:
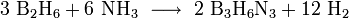
- Diboran reagiert mit Ammoniak zu Borazin und Wasserstoff.
Alternativ sind als Edukte auch Lithiumborhydrid und Ammoniumchlorid verwendbar, was zu einer höheren Ausbeute führt:
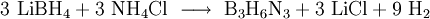
- Lithiumborhydrid und Ammoniumchlorid werden zu Borazin, Lithiumchlorid und Wasserstoff ungesetzt.
Eine weitere Borazinsynthese ist folgende:
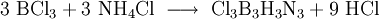
- Zunächst werden Bortrichlorid und Ammoniumchlorid zu Trichlorborazin und Chlorwasserstoff umgesetzt.
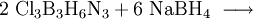
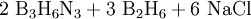
- In einem zweiten Schritt wird Trichlorborazin mit Natriumborhydrid zu Borazin reduziert. Als Nebenprodukte entstehen Diboran und Natriumchlorid.
Eigenschaften
In Wasser zersetzt sich Borazin zu Borsäure, Ammoniak und Wasserstoff. Borazin (Bildungsenthalpie ΔHf = −531 kJ/mol) ist thermisch sehr beständig.
Struktur
Borazin ist isoster zu Benzol. Das heißt, die Bindungen und Bindungsverhältnisse stimmen mit denen im Benzol überein oder ähneln sich sehr stark. Der C-C-Abstand im Benzol liegt bei 0,1397 nm. Der Bindungsabstand zwischen Bor und Stickstoff beträgt im Borazin 0,1436 damit liegt er erwartungsgemäß zwischen dem Wert für eine B-N-Einfachbindung (0,151 nm), wie man sie im Bornitrid vorfindet, und dem für eine B-N-Doppelbindung (0,131 nm).
Mesomerie
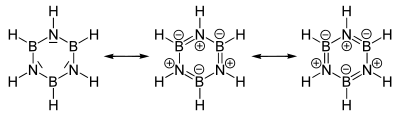 Mesomeriemodell des Borazins
Mesomeriemodell des BorazinsDer Elektronegativitätsunterschied zwischen Bor (2,04 nach Pauling-Skala) und Stickstoff (3,04) sowie der Elektronenmangel am Bor-Atom und das freie Elektronenpaar beim Stickstoff begünstigen die Ausbildung mesomerer der Borazin-Struktur. Bor spielt hierbei die Rolle einer Lewis-Säure, Stickstoff die einer Lewis-Base.
Reaktionen
Aufgrund der Verschiedenheit der Atome und damit der Polarität der B-N-Bindungen ist Borazin chemisch wesentlich reaktiver als Benzol. So reagiert Borazin leicht mit polaren Verbindungen wie Chlorwasserstoff, Wasser und Methanol. Chlorwasserstoff reagiert in einer Additionsreaktion mit Borazin. Mit Benzol würde diese Reaktion nicht stattfinden. Die Umsetzung mit Brom benötigt keinen Katalysator.
Verwendung
Borazin und seine Derivate sind von Interesse als potentielle Vorläuferprodukte auf dem Weg zu Bornitrid-Keramiken.
Quellen
Wikimedia Foundation.
