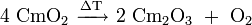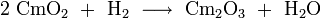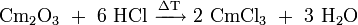- Dicuriumtrioxid
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Curium(III)-oxid Andere Namen - Curiumsequioxid
- Dicuriumtrioxid
Verhältnisformel Cm2O3 CAS-Nummer 12526-35-1 (244Cm) Kurzbeschreibung farbloser bis schwach bräunlicher Feststoff[1] Eigenschaften Molare Masse je nach Isotop: 524–552 g·mol−1 Aggregatzustand fest
Schmelzpunkt 2270±25 °C[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Curium(III)-oxid ist ein Oxid des Elements Curium. Es besitzt die Summenformel Cm2O3.
Inhaltsverzeichnis
Vorkommen
Da alle Isotope des Curiums nur künstlich hergestellt sind, besitzt Curium(III)-oxid keine natürlichen Vorkommen.
Herstellung
Curium(III)-oxid kann durch thermische Zersetzung von Curium(IV)-oxid im Vakuum (ca. 0,01 Pa) bei 600 °C erhalten werden:[4]
Ein weiterer Weg ist durch die Reduktion von Cm(IV)-oxid mit molekularem Wasserstoff gegeben:[5]
Eigenschaften
Es handelt sich um einen farblosen bis leicht bräunlichen Feststoff, der bei etwa 2270 °C schmilzt. Von Curium(III)-oxid sind drei Modifikationen bekannt. Die α-Form kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P3m1 und den Gitterparametern a = 380 pm und c = 599 pm. Die β-Form des Curium(III)-oxids weist ein monoklines Kristallsystem mit den Gitterparametern a = 1428 pm, b = 364 pm, c = 888 pm auf. Das in γ-Mangan(III)-oxid-form kristallisierende γ-Curium(III)-oxid besitzt den Gitterparameter a = 1100 pm und die Raumgruppe Ia3.[6]
Verwendung
Curium(III)-chlorid kann zur Herstellung weiterer Curiumsalze herangezogen werden. Durch Auflösen des Oxids in Säuren können die entsprechenden Salze erhalten werden. So kann beispielsweise Curiumperchlorat durch das Auflösen von Curiumoxid in Perchlorsäure hergestellt werden.
Durch die Umsetzung mit wasserfreiem Chlorwasserstoff bei 400–600 °C kann Curium(III)-chlorid gewonnen werden.[7]
Einzelnachweise
- ↑ Lester R. Morrs, Norman M. Edelstein, Jean Fuger, The Chemistry of the Actinide and Transactinide Elements: Bd. 3, 2006, Springer.
- ↑ R. J. M. Konings: "Thermochemical and Thermophysical Properties of Curium and its Oxides", in: J. Nucl. Mater. 2001, 298 (3), 255–268; doi:10.1016/S0022-3115(01)00652-3.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ L. B. Asprey, F. H. Ellinger, S. Fried, W. H. Zachariasen: "Evidence for Quadrivalent Curium: X-Ray Data on Curium Oxides", in: J. Am. Chem. Soc. 1955, 77 (6), 1707–1708; doi:10.1021/ja01611a108.
- ↑ H. O. Haug: "Curium Sesquioxide Cm2O3", in: J. Inorg. Nucl. Chem. 1967, 29 (11), 2753–2758; doi:10.1016/0022-1902(67)80014-9.
- ↑ M. Noé, J. Fuger, G. Duyckaerts: "Some recent Observations on Curium Sesquioxide", in: Inorg. Nucl. Chem. Lett., 1970, 6 (1), 111–119; doi:10.1016/0020-1650(70)80294-X.
- ↑ J. C. Wallmann, J. Fuger, J. R. Peterson, J. L. Green: "Crystal Structure and Lattice Parameters of Curium Trichloride", in: J. Inorg. Nucl. Chem. 1967, 29 (11), 2745–2751; doi:10.1016/0022-1902(67)80013-7.
Wikimedia Foundation.