- Dicyan
-
Strukturformel 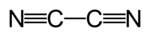
Allgemeines Name Dicyan Andere Namen - Cyan
- Cyanogen
- Oxalsäuredinitril
- Oxalyldinitril
- Zyan
Summenformel C2N2 CAS-Nummer 460-19-5 PubChem 9999 Kurzbeschreibung farbloses, stechend bittermandelartig riechendes Gas[1]
Eigenschaften Molare Masse 52,04 g·mol–1 Aggregatzustand gasförmig
Dichte 0,95 g·cm–3 (flüssig, −21 °C)[2]
2,38 g·l–3 (Gas, 0 °C, 1013 mbar)[2]Schmelzpunkt Siedepunkt −21 °C[2]
Dampfdruck Löslichkeit - Zersetzung in Wasser[1]
- löslich in Ethanol und Diethylether[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 



Gefahr
H- und P-Sätze H: 220-331-410 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 


Hoch-
entzündlichGiftig Umwelt-
gefährlich(F+) (T) (N) R- und S-Sätze R: 12-23-50/53 S: (1/2)-9-16-23-33-45-63-60-61 MAK 5 ml·m−3, 11 mg·m−3[2]
LD50 LC50 (Ratte, inhalativ): 350 ppm in 60 min [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dicyan ist eine giftige, gasförmige chemische Verbindung. Sie besteht aus zwei durch eine Einfachbindung verbundenen Cyanid-Gruppen. Kurz wird sie auch als Cyan oder Zyan bezeichnet.
Inhaltsverzeichnis
Geschichte
Dicyan wurde wahrscheinlich zum ersten Mal 1782 durch Carl Wilhelm Scheele synthetisiert, als er Blausäure untersuchte. Definitiv wurde es 1802 synthetisiert, als Chlorcyan hergestellt wurde. Noch vor der als solcher allgemein anerkannten „ersten“ Synthese organischer Substanzen (Harnstoff, Friedrich Wöhler, 1828) gelang F. Wöhler die Synthese von Oxalsäure durch Hydrolyse von Dicyan (1824).[5]
Gewinnung und Darstellung
Im Labor wird Dicyan durch Erhitzung von Quecksilber(II)-cyaniden dargestellt. Technisch wird es durch die Oxidation von Blausäure gewonnen, wobei gewöhnlich Chlor an einem aktivierten Siliciumdioxid-Katalysator oder Stickstoffdioxid an Kupfersalzen verwendet wird. Dicyan wird auch aus Stickstoff und Ethylen unter Einwirkung elektrischer Entladungen gebildet. Weiterhin entsteht es bei der Reaktion von Cu(II)-Salzen in wässriger Lösung mit einem Überschuss Cyanidsalz unter Bildung von Tetracyanocuprat(I).
Eigenschaften
Dicyan ist ein farbloses und giftiges, stechend-süßlich riechendes Gas mit einem Siedepunkt von −21 °C. Es verbrennt mit sehr heißer (4800 K in reinem Sauerstoff[6]), rot-violetter Flamme. Cyan verhält sich chemisch ähnlich wie ein Halogen und wird daher als Pseudohalogen bezeichnet. Die Hydrolyse führt zum Oxamid und weiter zu Ammonium-Oxalat, dem entsprechenden Salz der Oxalsäure. Dicyan bildet mit Luft leicht entzündliche Gemische. Der Explosionsbereich liegt zwischen 3,9 Vol% (84 g/m3) als untere Explosionsgrenze (UEG) und 36,6 Vol% (790 g/m3) als obere Explosionsgrenze (OEG).[7]
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c d e f Eintrag zu CAS-Nr. 460-19-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Januar 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 460-19-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Dicyan bei ChemIDplus
- ↑ Burckhard Frank: 250 Jahre Chemie in Göttingen. In: Hans-Heinrich Voigt (Hrsg.): Naturwissenschaften in Göttingen. Eine Vortragsreihe. Vandenhoeck + Ruprecht Gm, Göttingen 1988, ISBN 3-525-35843-1 (Göttinger Universitätsschriften. Band 13), S. 72 ([1] und [2])
- ↑ Römpp DC 2006, Georg Thieme Verlag 2006
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
Kategorien:- Feuergefährlicher Stoff
- Umweltgefährlicher Stoff
- Giftiger Stoff
- Pseudohalogen
- Nitril
Wikimedia Foundation.
