- Dreieckspannungsmethode
-
Die Cyclovoltammetrie oder zyklische Voltammetrie oder Dreieckspannungsmethode ist ein analytisches Verfahren, mit dem man rasch einen Überblick über verschiedene Elektrodenprozesse gewinnen kann.
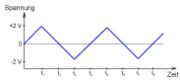
Bei der Zyklovoltammetrie wird an die Arbeitselektrode in einer Lösung ein ansteigendes und anschließend ein abfallendes Potential angelegt (oder umgekehrt). Von diesem dreieckförmigen oder sägezahnförmigen Spannungsverlauf kommt der Name Dreieckspannungsmethode. Das Potential der Arbeitselektrode wird mittels einer sogenannten Bezugselektrode genau bestimmt. Da die Arbeitselektrode kurzzeitig zur Kathode, dann zur Anode wird, nennt man die Potentiale, bei denen der Verlauf wechselt, nennt man dementsprechend kathodisches beziehungsweise anodisches Umkehrpotential. In einer wässrigen Lösung werden sie zweckmäßigerweise so gewählt, dass sie den Bereich zwischen Sauerstoff- und Wasserstoffentwicklung (die aus der Zersetzung von Wasser resultieren) abdecken. Die zu untersuchende Lösung wird dabei nicht gerührt.Wenn sich in der Lösung ein elektroaktiver Stoff befindet, wird dieser bei einem charakteristischen Potential oxidiert oder reduziert. Die Stromstärke wird in Abhängigkeit zur Spannung (X-Y-Schreiber oder Oszilloskop) aufgezeichnet. Die Peaks (bei der Oxidation und Reduktion), d. h. die Spannungswerte mit maximaler (minimaler) Stromstärke, sind von Interesse. Der Spannungswert zwischen dem Oxidations- und dem Reduktionspeak gibt das Normalpotential einer elektrolytischen Reaktion an. Nun ist es möglich, dass bei einem Spannungsanstieg nicht nur ein, sondern mehrere Peaks sichtbar werden. Hierbei wird eine Substanz über mehrere Stufen oxidiert (reduziert). Durch Änderung des zeitlichen Spannungsanstiegs können sich die Peaks verändern.
Inhaltsverzeichnis
Detaillierte Beschreibung der Vorgänge
Liegt zunächst keine Spannung an, fließt kein Strom, da keine elektrochemische Substanz oxidiert (reduziert) wird. Steigt nun die Spannung recht schnell an, setzt ab einer bestimmten Spannung ein Stromfluss ein. Direkt an der Oberfläche der Elektrode werden nun Teilchen oxidiert (z.B. Fe(+II) zu Fe(+III)). Dabei ändert sich sofort das Verhältnis von oxidierten zu reduzierten Teilchen direkt vor der Elektrode nach der Nernstgleichung. Wenn die Konzentration der oxidierten und reduzierten Komponenten vor der Elektrode gleich ist, entspricht das Potential genau dem Standardpotential eines Redoxprozesses der Nernstgleichung. Der Strom an diesem Punkt entspricht der Hälfte des maximal erreichbaren Stromes. Verdoppelt sich die Stromstärke, erreicht man den sogenannten Grenzstrom. Bei dieser Stromstärke sind alle elektroaktiven Teilchen an der Oberfläche vor der Elektrode oxidiert (oder reduziert). Bei einer normalen Elektrolyse verarmen die reduzierbaren Teilchen vor der Elektrode. Nach wenigen Sekunden bildet sich eine Schicht (Diffusionsschicht) von reduzierbaren Teilchen vor der Elektrode aus. Nur durch Wanderung können die Ionen zur Elektrode gelangen. Aufgrund des Konzentrationsprofils vor der Elektrode können nun bedeutend weniger Teilchen von der Elektrode oxidiert werden, da die reduzierte Form (z. B. Fe(+II)) nun nicht mehr in konzentrierter Form direkt vor der Elektrode vorliegt. Diese Diffusionsschicht bedeutet weniger Stoffumsetzung, geringeren Strom bzw. Diffusionsüberspannung .
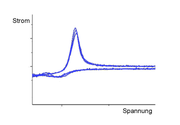
Wenn jedoch nur ein zeitlich sehr kurzer Spannungsimpuls erfolgt, kann die Ausbildung einer größeren Diffusionsschicht vermieden werden. Ist der Grenzstrom erreicht, kann man in der Strom-Spannungskurve einen Peak erkennen. Nun sinkt die Stromstärke (Abhängigkeit: Quadratwurzel der Zeit) wieder, da sich eine Diffusionsschicht bildet, die den Stromfluss verringert.
Bei Erreichen der Spitze der Dreickspannung sinkt die Spannung wieder. Immer weniger Teilchen werden nun oxidiert. Wenn die Dreickspannung in den negativen Bereich geht, können nun die zuvor oxidierten Teilchen vor der Elektrode reduziert werden. Der Strom fließt in die entgegengesetzte Richtung. Der Peak in der entgegengesetzten Richtung gibt den Grenzstrom für die Reduktion an.
Mathematisch lassen sich Strom-Spannungskurven aus Konzentrationen, Diffusionskoeffizienten, Spannungsvorschubgeschwindigkeit berechnen und mit den gefundenen Werten vergleichen.
Weiteres
Im Cyclovoltammogramm tritt dann ein Peak (engl. Höchstwert, Spitze) auf, den man als Überlagerung einer Stufenkurve (wie sie in der Polarografie auftritt) und einer Stromverlaufskurve einer diffusionskontrollierten Elektrodenreaktion (Cottrell-Kurve) interpretieren kann. Die genaue Form dieser Kurve hängt auch von der Vorschubgeschwindigkeit des Potentials (Frequenz der Sägezahnspannung) ab. Aber auch ohne elektroaktive Spezies kann die elektrochemische Reaktion der (oft aus einem Metall bestehenden) Elektrode mit dem Lösungsmittel, zum Beispiel die Oxidation zu einem Peak führen, des Weiteren können ebenfalls Adsorptionsprozesse an der Messelektrode zu Peaks führen ("Deckschichtdiagramm").
Bei einem reversiblen Elektrodenprozess ist das Potential an der Elektrodenoberfläche durch die Nernst-Gleichung bestimmt. Wegen der Diffusionskontrolle gilt das 1. Fick'sche Gesetz. Daraus kann die Stromdichte iP berechnet werden. Die entsprechende Randles-Sevčik-Gleichung lautet für den anodischen Halbzyklus:
- iP=2,69.105n3/2ν1/2Dred1/2cred
- n: Anzahl der Elektronen
- ν: Vorschubgeschwindigkeit des Potentials
- Dred: Diffusionskoeffizient der reduzierten Form des untersuchten Stoffes
- cred: Konzentration dieses Stoffes
Für den kathodischen Halbzyklus gilt eine entsprechende Formel.
Eine genaue quantitative Erfassung der Messung ist auch möglich, wobei sich je nach Art der Elektrodenprozesse (reversibel oder irreversibel) verschiedene mathematische Ausdrücke ergeben. Allerdings können auch beide kombiniert auftreten.
Mit Hilfe der Cyclovoltammetrie kann man die Kinetik einer chemischen Reaktion aufklären. Normalerweise bedient man sich dabei bestimmter Diagnosekriterien, die für verschiedene Reaktionsmechanismen charakteristisch sind.
Neben Redoxreaktionen lassen sich bei geeigneter Reaktionsführung auch weitere reversible und irreversible Prozesse in einem cyclovoltammetrischen Experiment beobachten, etwa das Aufladen der Doppelschichtkapazität C, für das sich die Stromdichte j errechnet zu j = - ν C.
Literatur
- J. Heinze: Cyclovoltammetrie - die „Spektroskopie“ des Elektrochemikers. In: Angewandte Chemie. 96, 1984, S. 823-840 (doi:10.1002/ange.19840961104).
- Bernd Speiser: Cyclische Voltammetrie, Chemie in unserer Zeit 15. Jahrgang, April 1981, Seite 62-68
Weblinks
- iP=2,69.105n3/2ν1/2Dred1/2cred
Wikimedia Foundation.