- E210
-
Strukturformel 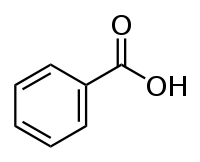
Allgemeines Name IUPAC: Benzoesäure (gebräuchlich) Andere Namen - Phenylameisensäure
- Benzolcarbonsäure
- Benzencarbonsäure
- IUPAC: Phenylcarbonsäure (systematisch)
- Carboxybenzen
- Monophenylmethansäure
Summenformel C7H6O2 CAS-Nummer 65-85-0 Kurzbeschreibung farbloser Feststoff [1] Eigenschaften Molare Masse 122,12 g·mol−1 Aggregatzustand fest
Dichte 1,27 g·cm−3 [1]
Schmelzpunkt 122,1 °C [1]
Siedepunkt 250 °C [1]
Dampfdruck pKs-Wert 4,2 [2]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: 24 MAK nicht festgelegt [1]
LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Benzoesäure ist eine aromatische Carbonsäure. Sie besteht aus einem Phenylrest mit einer Carboxylgruppe. Die Salze und Ester der Benzoesäure werden Benzoate genannt.
Inhaltsverzeichnis
Eigenschaften
Benzoesäure bildet farblose, glänzende Blättchen oder nadelförmige Kristalle, die in kaltem Wasser nur wenig, in warmem Wasser dagegen besser löslich sind. Über 370 °C zersetzt sich Benzoesäure in Benzol und Kohlenstoffdioxid (CO2). Benzoesäure hat einen intensiven Geruch und ist gut brennbar.
Vorkommen
Als ein Hauptbestandteil des Harzes Benzoe ist Benzoesäure in vielen Weihrauchmischungen enthalten. Benzoe ist das Harz zweier Baumarten (Siam-Benzoe und Sumatra-Benzoe), die in Südostasien beheimatet sind. Daneben findet sich Benzoesäure auch in Früchten, zum Beispiel Pflaumen, Heidel- und Preiselbeeren.
Herstellung
Technisch erfolgt die Herstellung durch eine Oxidation von Toluol mit Braunstein und Schwefelsäure in Gegenwart von Mangannaphthenat, oder durch die Reaktion mit Kaliumpermanganat. Industriell wird heute Toluol mit Sauerstoff in Gasphase in Gegenwart von Katalysatoren wie z. B. Vanadiumpentoxid oxidiert.
Des Weiteren kann Benzoesäure über eine Grignard-Reaktion ausgehend von Brombenzol hergestellt werden. Das Brombenzol reagiert mit Magnesium zu Phenylmagnesiumbromid, welches mit Kohlenstoffdioxid zu C6H5COOMgBr und schließlich durch Zugabe einer Salzsäurelösung zu Benzoesäure reagiert.
Verwendung
Benzoesäure wird bei der Herstellung von Benzoesäureestern gebraucht, die in der Parfümindustrie Anwendung finden. Außerdem wird Benzoesäure für Weichmacher, bei der Darstellung von Benzoylverbindungen, wie beispielsweise Benzoylchlorid und Dibenzoylperoxid, verwendet.
In der Lebensmittelindustrie wird Benzoesäure (E 210) als Konservierungsstoff vor allem bei sauer eingelegten Lebensmitteln eingesetzt. Wegen besserer Löslichkeit ist eher die Verwendung der Salze üblich: Natriumbenzoat (E 211), Kaliumbenzoat (E 212), Calciumbenzoat (E 213).[4]
In der Umweltbeobachtung wird übersättigte Benzoesäure für die Befüllung von Bodenfallen verwendet, um die zu erfassenden Lebewesen wie Laufkäfer oder Schnecken zu töten und bis zur nächsten Leerung haltbar zu machen. Auch für größere Tiere wie Hunde und Katzen ist Benzoesäure hochgiftig.
Benzoesäure wird häufig in haltbaren Nahrungsmitteln wie z. B. in Ketchup, Wurst, Senf und anderen Soßen, Margarine, Fischsalaten und vielen anderen Produkten als Konservierungsstoff verwendet. Die bakteriostatische und fungistatische Wirkung beruht auf dem Hemmeffekt gegenüber Enzymen, die reaktive Sauerstoffspezies abbauen (Katalase und Peroxidase), wodurch eine Wasserstoffperoxid-Ansammlung in den Zellen der Mikroorganismen erzeugt wird. Diese führt letztlich zu deren Absterben. Im menschlichen Organismus ist Benzoesäure unschädlich, da eine Akkumulation durch das Umwandeln und Ausscheiden der Substanz als Hippursäure verhindert wird.
Benzoesäure kann pseudoallergische Reaktionen auslösen.[1] Die Verbindung wird im Zusammenhang mit Konzentrationsproblemen und Hyperaktivität bei Kindern diskutiert.[5][6]
Benzoesäure ist eine Urtitersubstanz nach Arzneibuch.
Quellen
- ↑ a b c d e f g h i Eintrag zu Benzoesäure in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 22. Aug. 2007 (JavaScript erforderlich)
- ↑ Charles E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme 2003, ISBN 3-13-484308-0
- ↑ Benzoesäure bei ChemIDplus
- ↑ ZZulV: Anlage 5 (zu § 5 Abs. 1 und § 7) - Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind
- ↑ Artikel in der Ärztezeitung zu Studie der britischen Foods Standards Agency
- ↑ Artikel auf Welt-Online
Weblinks
Wikimedia Foundation.