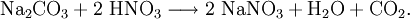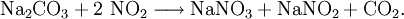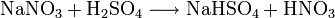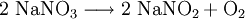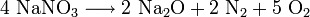- E251
-
Strukturformel 
Allgemeines Name Natriumnitrat Andere Namen - Natronsalpeter
- Chilesalpeter
- Salpetersaures Natrium
- E 251
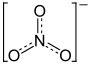
Summenformel NaNO3 CAS-Nummer 7631-99-4 PubChem 24268 Kurzbeschreibung farbloser, kristalliner Feststoff Eigenschaften Molare Masse 84,99 g·mol–1 Aggregatzustand fest
Dichte 2,26 g·cm–3 (20 °C) [1]
Schmelzpunkt 306-307 °C [1]
Siedepunkt Zersetzung ab 380 °C [1]
Löslichkeit leicht löslich in Wasser: 874 g·l−1 (20 °C)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Brand-
förderndGesundheits-
schädlich(O) (Xn) R- und S-Sätze R: 8-22 S: 22-41 LD50 1267 mg·kg−1 (Ratte, oral)[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumnitrat (auch Natronsalpeter oder Chilesalpeter) ist eine chemische Verbindung, das Natriumsalz der Salpetersäure. Im reinen Zustand liegt es in Form einer hygroskopischen (wasseranziehenden), weißen Substanz oder farblosen Kristallen vor.
Inhaltsverzeichnis
Vorkommen
Natriumnitrat ist das wichtigste natürlich vorkommende Nitrat. Hauptfundort ist Chile, daher auch der Trivialname Chilesalpeter. Weitere natürliche Vorkommen gibt es in Ägypten, Kleinasien, Kolumbien und Kalifornien.
Gewinnung
Natürliche Vorkommen werden durch Auslaugung mit heißen Solen gewonnen und durch Filtration von Fremdstoffen gereinigt. Das in der Kälte auskristallisierte Natriumnitrat hat eine Reinheit von etwa 98 %. Das in den Mutterlaugen enthaltene Iodat geht in die Iodgewinnung.
Natriumnitrat kann auch durch Umsatz von Natriumcarbonat mit Salpetersäure gewonnen werden:
Hier bietet sich die Absorption von Restgasen der Ammoniakoxidation in konzentrierter Natriumcarbonat-Lösung an:
Zur Oxidation des Nitrits wird mit Salpetersäure angesäuert, an der Luft zu Nitrat oxidiert und mit Natriumcarbonat neutralisiert. In Vakuumverdampfern wird es bis zum Feststoff eingeengt.
Eigenschaften
Physikalische Eigenschaften
- wichtige thermodynamische Eigenschaften
Chemische Eigenschaften
In heißer Schwefelsäure wird es unter Bildung von Salpetersäure zu Natriumhydrogensulfat umgesetzt:
Bei Temperaturen oberhalb von 380 °C zersetzt es sich zu Natriumnitrit:
Bei Temperaturen oberhalb von 800 °C zu Natriumoxid:
Verwendung
- Düngemittel
- Baustoffindustrie: Zementzusatz
- Hilfsstoff in chemischen Abflussreinigern
- Chemikalienherstellung: Kaliumnitrat
- früher auch zur Salpetersäureherstellung
- als Konservierungsmittel E 251
- zum Pökeln von Fleisch- und Wurstwaren (auch mit Natriumnitrit E 250 und Kaliumnitrit E 249)
- PCM zur thermischen Speicherung
Lebensmittelzusatzstoff
Nitrat wirkt gegen Bakterien, vor allem gegen den gefürchteten Botulismus-Erreger (Clostridium botulinum). Beim Pökelprozess wird der chemisch wenig beständige Muskelfarbstoff (Myoglobin) in eine stabilere Variante umgewandelt (Umrötung). Als Folge davon behält das Fleisch seine rote Farbe. Nicht gepökelte Fleisch- und Wurstwaren nehmen eine graue Farbe an, die von den meisten Kunden fälschlicherweise als Hinweis auf einen Verderb angesehen wird. Zudem wird beim Pökeln ein typisches Aroma ausgebildet.
Natriumnitrat wird für Wurstwaren, Hartkäse, Schnittkäse, eingelegte Heringe und Sprotten verwendet.
Nitrate selbst sind ungefährlich. Problematisch ist ihr Einsatz, weil sie in Nitrite umgewandelt werden. Diese Umwandlung ist im Lebensmittel, aber auch im menschlichen Körper möglich. Nitrite wirken gefäßerweiternd und blutdrucksenkend. In höheren Dosierungen können sie zu akuten Vergiftungserscheinungen (Mangel an Blutfarbstoff Hämoglobin = Zyanose) führen. Nitrit kann mit gleichzeitiger Aufnahme von Protein im menschlichen Körper zu stark krebserregenden Nitrosaminen umgewandelt werden.
Nachweis
- Nachweisreaktionen
- Natrium: als hell leuchtend gelb in der blauen Bunsenbrennerflamme
- Nitrat: Spatelspitze Substanz mit verdünnter Schwefelsäure lösen und mit einer kalt gesättigten Eisen(II)-sulfatlösung versetzen. Mit etwas konzentrierter Schwefelsäure unterschichten. An der Grenzschicht entsteht ein brauner Ring, der als Nachweis für Nitrat gilt (Ringprobe).
Quellen
- ↑ a b c d e Eintrag zu Natriumnitrat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 12. März 2009 (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt (Merck)
Wikimedia Foundation.

.jpg)