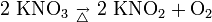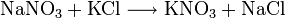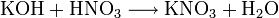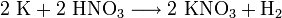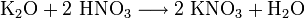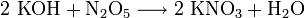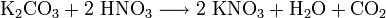- E252
-
Strukturformel 
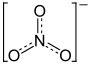
Allgemeines Name Kaliumnitrat Andere Namen - Salpeter
- Kalisalpeter
Summenformel KNO3 CAS-Nummer 7757-79-1 PubChem 24434 Kurzbeschreibung weißes, kristallines Pulver Eigenschaften Molare Masse 101,11 g·mol−1 Aggregatzustand fest
Dichte 2,109 g·cm−3 (16 °C)[1]
Schmelzpunkt Siedepunkt Zersetzung >400 °C[1]
Löslichkeit gut löslich in Wasser: 316 g·l−1 (20 °C)[1]), schlecht in unpolaren Lösungsmitteln
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Brand-
fördernd(O) R- und S-Sätze R: 8 S: 17-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumnitrat, im allgemeinen Sprachgebrauch besser bekannt als Salpeter, im Speziellen als Kalisalpeter, ist das Kaliumsalz der Salpetersäure.
Inhaltsverzeichnis
Eigenschaften
Kaliumnitrat bildet farblose Kristalle, die sich in Wasser unter starker Abkühlung lösen. Es ist deshalb in warmem Wasser viel leichter löslich als in kaltem Wasser. In 1 Liter Wasser von 0 °C können bis zu 130 g Kaliumnitrat gelöst werden, in 1 Liter Wasser von 100 °C sind es bis zu 2455 g Kaliumnitrat. Die Dichte der Lösung ist bei solch hohen Konzentrationen wesentlich höher als die des reinen Wassers.
Kaliumnitrat zersetzt sich beim Erhitzen zu Kaliumnitrit und Sauerstoff:
Es ist bei erhöhten Temperaturen ein hervorragendes Oxidationsmittel. Verkohlte Rückstände in Glasgeräten lösen sich in geschmolzenem Kaliumnitrat rasch auf.
Kaliumnitrat ist deutlich weniger hygroskopisch als viele andere Nitrate, z. B. Natriumnitrat.
Gewinnung
Natürliche Vorkommen
Kaliumnitrat (min. „Nitrokalit“) kommt als Ausblühung auf Böden vor. Von wirtschaftlicher Bedeutung waren die Vorkommen in China und Südostasien, wo in der ersten Hälfte des 19. Jahrhunderts durch Auslaugen solcher Böden mehr als 10000 t Salpeter jährlich gewonnen wurden.
Bakterielle Nitrifikation stickstoffreicher organischer Abfälle
Von Ende des 14. bis in das 19. Jahrhundert wurde in Europa die mit Hilfe von Bakterien und Luftsauerstoff Erzeugung von Salpeter betrieben, um vom Import dieses für Kriegszwecke unentbehrlichen Rohstoffes unabhängig zu sein. (siehe „Geschichte“). Man vermengt stickstoffreiche organische Abfälle (Dung und Harn) mit Kalk und Holzasche (Pottasche) und lässt diese in lockeren, luftdurchlässigen Erdhaufen verwesen. Dabei werden die Stickstoffverbindungen durch Bakterien zu Nitraten umgesetzt. Nach zwei Jahren wird die Masse mit Wasser ausgelaugt. Der Rohlauge wird Pottasche zugesetzt und dadurch Calcium-und Magnesiumnitrat zu Kaliumnitrat und schwerlöslichen Erdalkalicarbonat umgesetzt. Durch Eindampfen der filtrierten Lauge gewinnt man den Kalisalpeter, der durch Umkristallisation gereinigt wird.
Konversionssalpeter
Von Mitte des 19. Jahrhunderts bis etwa 1920 war die Konversion von Chilesalpeter mit Kaliumchlorid das wichtigste Verfahren zu Herstellung von Kaliumnitrat:
Dabei wird die geringe Zunahme der Löslichkeit von Natriumchlorid mit der Temperatur ausgenutzt: die Mutterlauge der KNO3-Kristallisation im vorausgegangenen Zyklus wird erwärmt und mit rohem Natriumnitrat und Kaliumchlorid (in stöchiometrischen Mengen) versetzt. Das Gemisch wird unter Zusatz von etwas Soda bei 100 °C eingeengt, wobei Natriumchlorid und Verunreinigungen (Erdalkalicarbonate) ausfallen und abfiltriert werden. Das Filtrat wird mit dem Kondensat der Eindampfung wieder verdünnt, um beim Abkühlen ein Ausfällen von Natriumsalzen zu vermeiden, klarfiltriert und dann bis auf 5 °C zur Kristallisation des Kaliumnitrats abgekühlt und zentrifugiert. Das abgeschiedene Kaliumnitrat wird für technische Zwecke umkristallisiert.
Synthetisch aus Salpetersäure
Heute wird das Kaliumnitrat synthetisch hergestellt (siehe Darstellung).
Darstellung
Es gibt viele Möglichkeiten Kaliumnitrat darzustellen:
- durch fast alle Salzbildungsreaktionen :
- aus Kaliumcarbonat:
Verwendung
- Kaliumnitrat wird zur Haltbarmachung von Lebensmitteln verwendet (Pökelsalz E 252)
- Zur Herstellung von Schwarzpulver und anderen pyrotechnischen Mischungen
- Ein Gemisch aus 24 % Bor + 71 % KNO3 + 5 % Binder (PMMA) dient als zuverlässige Anzündmischung, die auch bei sehr tiefen Temperaturen (−196 °C) brennt.
- Eine Mischung aus 60 % NaNO3 + 40 % KNO3 schmilzt bei 222 °C und wird als Wärmeträgermedium in solarthermischen Kraftwerken eingesetzt. Diese Salzschmelze ist chemisch stabil bis 590 °C, hat eine hohe spezifische Wärmekapazität von 1,55 kJ/(kg·K), eine Dichte von 1,79 g/cm3 und ist dünnflüssig wie Wasser (Viskosität: 2,1 mPa·s). Sie benetzt Metallflächen sehr leicht, was bei ungeeigneter Konstruktion und Materialauswahl zu Dichtungsproblemen führen kann. Edelstähle sind weitgehend beständig gegen Salpeterschmelzen (Abtragungsrate: 6–15 µm / Jahr bei 570 °C). Der Wärmeübergangskoeffizient am turbulent durchströmten Rohr beträgt etwa 6000 W/K·m2. Die Salpeterschmelze eignet sich aufgrund ihrer hohen Wärmekapazität (2,8 MJ/(K·m3)) zudem als Wärmespeichermedium. Durch Zusatz von Natriumnitrit kann die Schmelztemperatur weiter erniedrigt werden. Ein als HiTec bezeichnetes Salzgemisch aus 53 % KNO3 + 40 % NaNO2 + 7 % NaNO3 schmilzt bereits bei 140 °C und hat besonders günstige Eigenschaften als Wärmeträgermedium, wenn die Giftigkeit von Natriumnitrit ohne Belang ist.
- Salpeterbäder werden zur Wärmebehandlung von Aluminiumknetlegierungen mit Magnesiumgehalten bis 10 % verwendet. Die höchstzulässige Temperatur der Salzschmelze ist vom Magnesiumgehalt abhängig; sie sinkt von 550 °C bei 0,5 % Mg auf 380 °C bei 10 % Mg.
- in Rauchgranaten
- in Dünger
Geschichte
Bereits im 11.Jahrhundert wird Salpeter im Buch des Marcus Graecus, das auch erstmalig die Schwarzpulvermischung erwähnt, als neuer Stoff erwähnt, der von Erde und Steinen abgekratzt wird. Das vom Ende des 13. Jahrhundert stammende Buch über den berittenen Kampf und den Einsatz von Kriegsmaschinen von Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya) enthält bereits mehrere Vorschriften zur Reinigung des Salpeters mit Holzasche sowie zur Anfertigung von Brandsätzen und Treibstoff für Raketen.
Salpeter wurde anfangs aus Indien importiert; Venedig zog aus dem Zwischenhandel hohe Gewinne. Mit steigender Nachfrage und aus Gründen der Unabhängigkeit förderten vom Ende des 14. Jahrhunderts an die Regierungen die eigene Gewinnung von Salpeter und sicherten sich durch ein „Salpeterregal“ alle Rechte der Herstellung, des Importes und der Verwendung mittels drakonischer Gesetze. Durch die schnelle Sauerstoffabgabe war der Salpeter die Grundlage für die plötzliche Verbrennung von Schwefel und Holzkohle im Schießpulver und daher als chronisch knappe Substanz der strategische Rohstoff über sechs Jahrhunderte.
In Thüringen gab es im 16. Jahrhundert neun Salpetersiedereien. Die Moldauufer bei Prag waren mit „Sanitärbänken“ bedeckt, die Stadt Halle erteilte eine Konzession zur Salpetergewinnung an den Müllhalden. Die steigende Nachfrage nach Salpeter wurde teilweise durch weitere Importe, vor allem aus Indien, und durch eigene Anlagen gedeckt.
Ab dem Ende des 14. Jahrhunderts fand ein systematischer Anbau von Salpetergärten statt. Tierische Abfälle (Dung, Kot, Urin und Blut) wurden mit kalkhaltigen Erden, Erde von Fried- bzw. Schlachthöfen oder aus Mooren und mit Kalk, Schutt sowie Asche in Gruben gefüllt oder zu Haufen geschichtet und ab und zu mit Jauche oder Urin begossen. Durch die Zersetzung bildete sich nach ein bis zwei Jahren so viel Salpeter, dass er aus der Erde ausgewaschen werden konnte. Die Ausbeute betrug etwa 6:1, also aus 6 kg Salpetererde gewann man 1 kg Salpeter.
Salpetersieder als besonderer und sehr unbeliebter Berufsstand durften Grundstücke jederzeit betreten und dort nach Salpeter suchen. Das traf sogar für Kirchen im 17. und 18. Jahrhundert zu, wobei nur die Zeiten der Gottesdienste ausgenommen waren. In Schweden mussten die Bauern ihre Abgaben sogar teilweise in Salpeter entrichten.
Im 19. Jahrhundert kam es dann sogar zum Salpeterkrieg, den Chile gegen seine Nachbarländer führte, um in den alleinigen Besitz der riesigen Wüstenlagerstätten von Natronsalpeter („Caliche“) zu gelangen, der jetzt mit Kalisalzen sofort zum Kalisalpeter umgesetzt werden konnte. Dieses Verfahren der Konversion wurde ab 1916 schließlich vom Haber-Bosch-Verfahren der Erzeugung von Ammoniak aus Luft und Wasser mit nachfolgender Umsetzung zur Salpetersäure abgelöst.
Quellen
- ↑ a b c d Eintrag zu Kaliumnitrat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3.9.2007 (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt Carl Roth
Literatur
- R. H. Perry: Chemical Engineers´ Handbook. 4th ed., McGraw-Hill Book Company, New York, 1963, pp. 9–77
- G. H. Janz et al.: Physical Properties Data Compilations Relevant to Energy Storage II. Molten Salts, NSRDS, April, 1979
- J. Gartz: Kulturgeschichte der Explosivstoffe. E. S. Mittler & Sohn, Hamburg, 2006
Weblinks
Wikimedia Foundation.