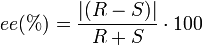- Enantiomere
-
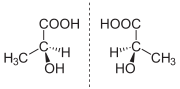 Struktur der beiden Enantiomere von Milchsäure. Links (S)-Milchsäure, rechts (R)-Milchsäure.
Struktur der beiden Enantiomere von Milchsäure. Links (S)-Milchsäure, rechts (R)-Milchsäure.Enantiomere sind Stereoisomere chemischer Verbindungen, die in ihrer Konstitution übereinstimmen, sie besitzen also die gleiche Summenformel und die Atome sind in gleicher Weise miteinander verknüpft. Da Enantiomere in sämtlichen Stereozentren jeweils die entgegengesetzte Konfiguration besitzen, gibt es theoretisch immer ein (−)- und ein (+)-Enantiomer, von denen in der Natur praktisch aber oftmals nur eines vorhanden ist. Die räumlichen Strukturen eines Enantiomerenpaars verhalten sich zueinander exakt wie Bild und Spiegelbild. Daher nennt man sie auch Spiegelbildisomere. Es handelt sich dabei also um eine Form der Konfigurationsisomerie. Sie können, im Gegensatz zu Konformationsisomeren, nicht durch Drehung von Atombindungen zur Deckung gebracht werden.
Inhaltsverzeichnis
Physikalische und chemische Eigenschaften
Diese Art der Isomerie wird als Chiralität (Händigkeit) bezeichnet. Ein alltägliches Beispiel für ein Paar von Enantiomeren sind unsere linken und rechten Schuhe, Füße und Hände sowie links- und rechtsdrehende Schrauben oder Muttern. Ein Molekül, das in zwei räumlichen Varianten vorkommt, ist die „rechtsdrehende“ und „linksdrehende“ Milchsäure im Joghurt. Enantiomere haben immer in sämtlichen Stereozentren die entgegengesetzte Konfiguration. Dem gegenüber stehen die Diastereomere, bei denen immer mindestens ein Stereozentrum von mehreren gleich und mindestens eines verschieden konfiguriert ist (siehe dort).
Enantiomere unterscheiden sich nicht in ihren physikalischen Eigenschaften (Summenformel, Schmelz- und Siedepunkte etc.), mit Ausnahme ihrer optischen Aktivität. Chemisch reine Enantiomere sind optisch aktiv, drehen also die Polarisationsebene des linear polarisierten Lichts im Uhrzeigersinn (rechtsdrehende Form, früher (+)-Form genannt) oder gegen den Uhrzeigersinn (linksdrehende Form, früher (−)-Form genannt). Enantiomere drehen die Polarisationsebene des linear polarisierten Lichts um den gleichen Betrag in entgegengesetzte Richtung.
Die beiden Enantiomere eines Eduktes reagieren in chemischen Reaktionen unterschiedlich, bei denen ein anderer enantiomerenreiner Reaktionspartner beteiligt ist. Die Reaktionsübergangszustände sind dann diastereomer zueinander. Auch beim Einsatz als pharmakologische Wirkstoffe in Organismen, rufen zueinander enantiomere Stoffe unterschiedliche Wirkungen hervor. Dies lässt sich mit einem Beispiel aus dem Alltag veranschaulichen mit dem Anziehen von Handschuhen: Es ist klar, dass nur der rechte Handschuh zur rechten Hand passt. Versucht man den rechten Handschuh auf die linke Hand zu ziehen, so wird man damit scheitern oder nur ein sehr dürftiges Ergebnis erzielen. Man erreicht also damit anstelle einer erwünschten Wirkung eine nutzlose oder schädliche und somit unerwünschte.
Bei der synthetischen Herstellung von unterschiedlich wirkenden enantiomeren Wirkstoffen etwa in der Pharmakologie versucht man heute, von vornherein nur noch das Enantiomer mit der gewünschten Wirkung herzustellen und als pharmazeutischen Wirkstoff einzusetzen, während man das andere Enantiomer mit seiner möglicherweise unerwünschten – bis hin zur toxischen – Wirkung von Anfang an ausschließen möchte (Enantioselektive Synthese). Alternativ kann ein Racemat (1:1-Mischung von zwei Enantiomeren) der Racematspaltung unterworfen werden, um einen einheitlichen (= enantiomerenreinen) Pharmawirkstoff zu gewinnen, der dann mit viel höherer Selektivität als das Racemat pharmakologisch wirksam werden kann. Es ist deshalb auch nicht überraschend, dass Enantiomere einen unterschiedlichen Geruch/Geschmack haben, weil die entsprechenden Rezeptoren im Körper stets selbst chiral (genauer: enantiomerenrein) sind.
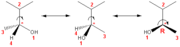 Beispiel für die Anwendung der Cahn-Ingold-Prelog-Konvention: die Substituenten werden nach ihrer Priorität geordnet, der Substituent niedrigster Priorität wird unter die Bildebene gedreht, die Richtung der Kreisbewegung an den Substituenten entlang definiert die absolute Konfiguration.
Beispiel für die Anwendung der Cahn-Ingold-Prelog-Konvention: die Substituenten werden nach ihrer Priorität geordnet, der Substituent niedrigster Priorität wird unter die Bildebene gedreht, die Richtung der Kreisbewegung an den Substituenten entlang definiert die absolute Konfiguration.R- und S-Sequenzregel (CIP-Regel)
- Enantiomere werden nach der R- und S-Sequenzregel eingestuft.
- Um herauszufinden, ob ein Enantiomer als R oder S einzustufen ist, muss man alle Substituenten nach ihrer Priorität ordnen: 1>2>3>4. Den Substituenten mit der niedrigsten Priorität (4) dreht man unter die Papierebene. Nun geht man von 1 über 2 nach 3.
- Wenn die Richtung, in der man gehen muss, mit dem Uhrzeigersinn verläuft, ist das Enantiomer R.
- Wenn die Richtung, in der man gehen muss, gegen den Uhrzeigersinn verläuft, ist das Enantiomer S.
- Siehe auch: Cahn-Ingold-Prelog-Konvention für eine Erklärung, wie man die Substituenten in ihre Prioritäten einstuft.
Nomenklatur
Zu Unterscheidung der Enantiomere bedient man sich der CIP-Konvention (Cahn-Ingold-Prelog-Konvention, auch R-S-Nomenklatur), mit der die räumliche Anordnung der Substituenten beschrieben wird. Bei bestimmten Substanzklassen (Zucker, begrenzt auf die Biochemie auch bei Aminosäuren) wird nach wie vor die ältere Fischer-Projektion (D,L-Nomenklatur) benutzt, die den Vorteil hat, dass die Bezeichnungen von verwandten Verbindungen gleich sind. Im Namen einer Verbindung kann man die Drehrichtung des Lichtes durch Voransetzen von „(+)-“ für rechtsdrehend beziehungsweise „(−)-“ für linksdrehend deutlich machen; z. B. (−)-Weinsäure oder (+)-Milchsäure, diese Beschreibung ist jedoch nicht immer eindeutig, weil das verwendete Lösungsmittel den Drehsinn in einigen Fällen beeinflussen und damit auch ändern kann.
Oft wird auch die Vorsilbe Levo- (links) für linksdrehende und Dextro- (rechts) für rechtsdrehende Substanzen verwendet, zum Beispiel Dextroamphetamin und Dextrose.
Racemat
Ein 1:1-Gemisch von (+)- und (−)-Form eines Stoffes, bei dem sich die optische Aktivität der einzelnen Stoffe ausgleicht, nennt man ein Racemat, z. B. (±)-Methionin (Synonyme: DL-Methionin und (RS)-Methionin). Es ist optisch nicht aktiv und hat einen Drehwinkel α von 0°, da sich die Anteile rechtsdrehender und linksdrehender Form gerade aufheben. Aus dem Quotienten des gemessenen Drehwinkels zum maximalen Drehwinkel des reinen Enantiomers multipliziert mit 100 ergibt sich die optische Reinheit (%) des Enantiomerengemisches. Unter der Annahme idealen Verhaltens (keine Wechselwirkung zwischen den beiden Enantiomeren und Gültigkeit des Lambert-Beerschen Gesetzes) ist die optische Reinheit gleich dem Enantiomerenüberschuss ee.
Der Schmelzpunkt eines Racemats weicht in der Regel vom Schmelzpunkt der reinen Enantiomeren ab.[1] Dabei kann der Schmelzpunkt das Racemates tiefer oder höher liegen als der der reinen Enantiomeren. Dieses auf den ersten Blick unerwartete Phänomen kann erklärt werden: Wenn das Racemat als racemisches Gemisch (Konglomerat) kristallisiert, liegen die Kristalle der (+)- und (−)-Form getrennt nebeneinander vor, d. h. das (+)-Enantiomere hat eine höhere Affinität zu (+)-Molekülen und das (−)-Enantiomere hat eine höhere Affinität zu (−)-Molekülen. Es entstehen also beim Kristallisieren nebeneinander reine (+)- und (−)-Kristalle. Der Schmelzpunkt des racemischen Gemischs liegt deutlich unter dem Schmelzpunkt der reinen Enantiomeren. Beispiel: Beide reinen (+)- und (−)-Enantiomere des Arzneistoffes Glutethimid schmelzen bei 102–103 °C. Hingegen hat (±)-Glutethimid, also das racemisches Gemisch, einen Schmelzpunkt von 84 °C.
Anders ist die Situation, wenn die (+)-Enantiomeren beim Kristallisieren bevorzugt mit den (−)-Enantiomeren zusammenlagern. Dann enthält jeder Kristall gleich viele Moleküle beider Enantiomere. Man nennt diesen Fall eine racemische Verbindung. Die racemische Verbindung unterscheidet sich in ihren physikalischen Eigenschaften von den reinen Enantiomeren. Der Schmelzpunkt kann höher, gleich oder niedriger liegen, als der der reinen Enantiomeren. Beispiel: Die reinen Enantiomeren des Arzneistoffes Ibuprofen haben einen Schmelzpunkt von 50–52 °C, racemisches Ibuprofen hat einen Schmelzpunkt von 75–77,5 °C. Racemisches Ibuprofen kristallisiert also als racemische Verbindung.
Geschichte
Im Jahre 1848 gelang Louis Pasteur die Racematspaltung für die Enantiomere eines Salzes der D- und L-Weinsäure. Sie unterschieden sich für ihn lediglich darin, dass ihre Kristalle spiegelbildlich aufgebaut waren. Nach sorgfältiger Kristallisation konnte er die verschiedenen Kristalle in mühevoller Handarbeit trennen und leitete damit die Erforschung der Enantiomerie ein. Auch bei der Zusammenführung von optischer Aktivität einer Substanz und der absoluten Konfiguration der Moleküle durch Johannes Martin Bijvoet spielte die Weinsäure eine wichtige Rolle. Natrium-Rubidium-Tartrat (ein Salz der Weinsäure) spielte eine zentrale Rolle bei der zuverlässigen Aufklärung der absoluten Konfiguration von enantiomerenreinen Molekülen. Die Entdecker wurden dafür mit dem Nobelpreis für Chemie ausgezeichnet.
Conterganskandal
Auf die unterschiedliche Wirkung der beiden Enantiomeren der sonst selben Substanz ist die Öffentlichkeit durch den Contergan-Skandal aufmerksam geworden, da allein dem (S)-Thalidomid eine teratogene (fruchtschädigende), dem (R)-Thalidomid jedoch eine beruhigende Wirkung zugesprochen wurde. Die Herstellung des reinen (R)-Enatiomers hätte dieses Problem jedoch nicht lösen können, da sich die Enantiomere im Fall des Contergans in einem dynamischen chemischen Gleichgewicht befinden und leicht racemisiert werden. In wissenschaftlichen Studien ist bisher bei keinem der Enantiomere eindeutig eine teratogene bzw. beruhigende Wirkung erkannt worden (obwohl es bei ähnlichen Verbindungen Hinweise darauf gibt, dass tatsächlich das (S)-Enantiomer teratogen wirksamer ist). Selbst wenn nur eines der Enantiomere teratogen wirkte, wäre dies bedeutungslos, da die Substanz im Körper racemisiert. Obwohl dieser Sachverhalt schon seit Jahren bekannt ist, hat die Geschichte vom „bösen“ und vom „guten“ Thalidomid noch immer viele Anhänger und wird sogar in einigen renommierten Fachzeitschriften und Lehrbüchern weiterverbreitet. Thalidomid wird heute zur Behandlung von Lepra und AIDS verwendet.
Chemie
Asymmetrische Synthese
Bei chemischen Synthesen chiraler Stoffe entstehen meist beide Enantiomere im gleichen Verhältnis. Sie müssen aufwendig getrennt werden, um die Enantiomere als Reinstoff zu erhalten. Die Synthese enantiomerenreiner Moleküle gehört zu den schwierigsten Feldern der präparativen Organischen Chemie. Einen Ausweg bieten hier zahlreiche neuere Syntheseverfahren die zum Teil sehr große Enantioselektivitäten aufweisen. Um ein chirales Molekül aus nicht-chiralen Edukten zugänglich zu machen, wurden verschiedene Methoden entwickelt:
- Verwendung chiraler Hilfsreagentien und Katalysatoren (z. B. chirale Phosphane)
- Umsetzung mit Enzymen
- Anbringung eines Auxiliars, das nach der Reaktion wieder entfernt werden kann
- Überführen in Diastereomere (durch Anbringung eines enantiomerenreinen Substitutenten wie (−)-Strychnin) und deren Trennung (z. B. Kristallisation, Säulenchromatographie u. a.)
Die hierbei erreichte Enantiomerenreinheit ist oft unterschiedlich hoch. Als Maß für den Erfolg der asymmetrischen Synthese/Kristallisation wird der Enantiomerenüberschuss angegeben:
Daneben bleibt die Synthese von enantiomerenreinen Wirkstoffen aus chiralen Naturstoffen (Beispiele: Aminosäuren, Zucker, Terpene, Alkaloide, Steroide) eine wichtige und effiziente Methode.
Biochemie
Viele biologisch wichtige Substanzen sind chiral, nicht nur die kleineren Moleküle von Aminosäuren und Zuckern, sondern auch biologische Makromoleküle wie Enzyme oder Rezeptoren. Bei einigen Substanzklassen überwiegt oft ein Chiralitätssinn, so herrscht beispielsweise bei den natürlichen Aminosäuren die L-Form vor. Chiralität als Folge des räumlichen Baus von Molekülen hat entscheidende Bedeutung für das Funktionieren biologischer Systeme, die alle selbst chiral sind. So sind viele Enzymreaktionen auf ein Enantiomer, entweder das linksdrehende oder das rechtsdrehende, spezialisiert, die Reaktionsgeschwindigkeit mit dem spiegelbildlichen Enantiomer als Substrat ist dann deutlich geringer oder es wird gar nicht umgesetzt. Gar nicht so selten entfaltet das „falsche“ Enantiomer auch eine völlig andere biologische Wirkung. Beispielsweise schmeckt bei einer bestimmten Verbindung das eine Enantiomer süß, während sein Partner bitter ist. Bei zahlreichen Geruchsstoffen unterscheidet sich der Geruchseindruck hinsichtlich Intensität und Ausprägung. Auch bei Pharmazeutika treten solche Effekte fast regelmäßig auf. Bei einigen Betablockern wirkt das eine Enantiomer selektiv auf das Herz, das andere an den Zellmembranen des Auges. Enzymreaktionen sind oft spezifisch für bestimmte Enantiomere, da das aktive Zentrum eines Enzyms vielfach das eine Enantiomer leichter aufnehmen kann als das andere (Schlüssel-Schloss-Prinzip, Substratspezifität). Das Enantiomere des Pharmawirkstoffes D-Penicillamin, also das L-Penicillamin, ist toxisch. Deshalb ist eine hohe Enantiomerenreinheit bei Arzneistoffen von überragender Bedeutung. Viele natürlich erzeugte Stoffe sind keine Racemate; die Biosynthese führt überwiegend oder ausschließlich zu einem Enantiomer. Racemate (= Enantiomerengemische im Verhältnis 1:1) können durch Racematspaltung getrennt werden. Die synthetische Chemie verfügt neuerdings über Methoden zur direkten gezielten Herstellung eines reinen Wirkstoffisomers durch enantioselektive oder gar enantiospezifische Synthesen nach dem Vorbild der Natur.
Literatur
- E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26, Nr. 6, 1984, S. 663–668 (doi:10.1007/BF00541922).
- Adam Sobanski, Roland Schmieder, Fritz Vögtle: Topologische Stereochemie und Chiralität. In: Chemie in unserer Zeit. 34, Nr. 3, 2000, S. 160–169 (doi:10.1002/1521-3781(200006)34:3<160::AID-CIUZ160>3.0.CO;2-6).
- Klaus Roth: Eine unendliche chemische Geschichte. In: Chemie in unserer Zeit. 39, Nr. 3, 2005, S. 212–217 (doi:10.1002/ciuz.200590038).
- Bernard Testa: Grundlagen der Organischen Stereochemie. Wiley-VCH, 1983, ISBN 3-527-25935-X.
- Uwe Meierhenrich: Amino acids and the asymmetry of life. Springer-Verlag, 2008, ISBN 978-3-540-76885-2.
Weblinks
Einzelnachweise
- ↑ Hermann J. Roth, Christa E. Müller und Gerd Folkers: Stereochemie & Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, ISBN 3-8047-1485-4, S. 161–162.
Wikimedia Foundation.

.png)