- Racemat
-
Ein Racemat (auch Razemat; von lat.: acidum racemicum = Traubensäure, mit der die erste Racemat-Trennung gelang; Aussprache Ra-ze-mát) ist ein äquimolares Gemisch von zwei Enantiomeren. Alle Racemate weisen somit ein Enantiomerenverhältnis von 1:1 auf. Ein Racemat dreht die Polarisationsebene von polarisiertem Licht nicht und ist optisch inaktiv, der Drehwert α beträgt also 0°.
Inhaltsverzeichnis
Erklärung
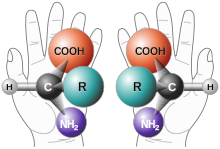
Moleküle, die sich wie Bild und Spiegelbild verhalten, gleichen sich und unterscheiden sich wie zwei zusammengehörige Fingerhandschuhe, von denen jeder in der gleichen Weise, nur anders in Bezug auf Links und Rechts, Raum für einen Daumen und vier Finger gibt. Das 1:1-Gemisch linker und rechter "Fingerhandschuhe" ist ein Racemat; Racematspaltung ist das Trennen (= Sortieren) linker und rechter Fingerhandschuhe.[1]
Eigenschaften
Die Unterscheidung, ob eine Verbindung als Racemat oder als eines der reinen Enantiomere vorliegt, ist insofern wichtig, als Enantiomere zwar gleiche physikalische[2], aber oft völlig unterschiedliche physiologische Eigenschaften aufweisen. So riecht D-(+)-Carvon nach Kümmel, während L-(–)-Carvon nach Minze riecht. D-(–)-Leucin schmeckt süß, während L-(+)-Leucin bitter schmeckt. Wichtig sind die Eigenschaften in der Pharmakologie, wo zum Beispiel der (S)-konfigurierte β-Blocker (Betarezeptorenblocker) 100mal stärker als das (R)-Enantiomer wirken kann.[3] Ein Enantiomer von Thalidomid, dem Wirkstoff des Schlafmittels Contergan, ist ein Teratogen (wirkt fruchtschädigend, siehe Contergan-Skandal). Hier ist eine Trennung der Enantiomere nutzlos, da sich jedes einzelne der Enantiomere bei oraler Einnahme in vivo in eine Mischung aus (S)- und (R)-Enantiomer umwandelt.[4][5] Ein Grund für die pharmakologisch unterschiedliche Wirkung von Enantiomeren eines racemischen Arzneistoffes in Organismen ist, dass Enzyme und Rezeptoren selbst chiral sind und nach dem Schlüssel-Schloss-Prinzip somit auf ein bestimmtes Enantiomer spezialisiert sind. Racemate von arzneilich oder ernährungsphysiologisch wirksamen Stoffen, wie sie bei einer chemischen Synthese meist entstehen, sind daher unerwünscht, da diese häufig nicht so spezifisch wirksam sind wie reine Enantiomere. Biotechnologische Verfahren, die Nutzung enantiomerenreiner Ausgangssubstanzen oder enantioselektive Synthesen führen meist direkt zu enantiomerenreinen Arzneistoffen. Alternativ werden enantiomerenreine Arzneistoffe durch Racematspaltung hergestellt. Ältere Arzneistoffe werden bis heute vielfach noch als Racemate eingesetzt, auch wenn mittlerweile die unterschiedliche pharmakologische Wirkung von Enantiomeren generell bekannt ist. In jüngerer Zeit wurden einige enantiomere Arzneistoffe entwickelt, um als Eutomer umsatzstarke Racemate zu ersetzen (siehe auch: enantiomerenreine Arzneistoffsynthese).
Den vollständigen oder anteiligen Abbau eines vorhandenen Enantiomerenüberschusses bezeichnet man als Racemisierung. Die Auftrennung eines Racemats in die einzelnen Enantiomere erfolgt durch Racematspaltung.[6]
Der Schmelzpunkt eines Racemats weicht in der Regel vom Schmelzpunkt der reinen Enantiomere ab.[7] Dabei kann der Schmelzpunkt das Racemates tiefer oder höher liegen als der der reinen Enantiomere. Dieses auf den ersten Blick unerwartete Phänomen kann erklärt werden: Wenn das Racemat als racemisches Gemisch (Konglomerat) kristallisiert, liegen die Kristalle der (+)- und (−)-Form getrennt nebeneinander vor, d. h. das (+)-Enantiomere hat eine höhere Affinität zu (+)-Molekülen und das (−)-Enantiomere hat eine höhere Affinität zu (−)-Molekülen. Es entstehen also bei der Kristallisation nebeneinander reine (+)- und (−)-Kristalle. Der Schmelzpunkt des racemischen Gemischs liegt deutlich unter dem Schmelzpunkt der reinen Enantiomeren. Beispiel: Beide reinen (+)- und (−)-Enantiomere des Arzneistoffes Glutethimid schmelzen bei 102–103 °C. Hingegen hat (±)-Glutethimid, also das racemisches Gemisch, einen Schmelzpunkt von 84 °C.
Anders ist die Situation, wenn die (+)-Enantiomere beim Kristallisieren bevorzugt mit den (−)-Enantiomeren zusammen kristallisieren. Dann enthält jeder Kristall gleich viele Moleküle beider Enantiomere. Man nennt diesen Fall eine racemische Verbindung. Die racemische Verbindung unterscheidet sich in ihren physikalischen Eigenschaften von den reinen Enantiomeren. Der Schmelzpunkt kann höher, gleich oder niedriger liegen, als der der reinen Enantiomere. Beispiel: Die reinen Enantiomere des Arzneistoffes Ibuprofen haben einen Schmelzpunkt von 50–52 °C, racemisches Ibuprofen hat einen Schmelzpunkt von 75–77,5 °C. Racemisches Ibuprofen kristallisiert also als racemische Verbindung.
Geschichte
Pasteur ließ 1847, im Alter von 25 Jahren, eine wässrige Lösung von racemischem Natrium-Ammonium-Tartrat auskristallisieren und trennte daraus einzelne Kristalle aufgrund ihrer asymmetrischen Form („hemihedrale Flächen“). Eine Lösung der Kristalle einer Sorte zeigte optische Aktivität in die eine, die andere in die entgegengesetzte Richtung – das Racemat war in Enantiomeren getrennt. Man zweifelte Pasteurs Arbeit an und er musste sie unter der Aufsicht von Jean-Baptiste Biot wiederholen, was gelang. Pasteur hatte Glück: Wäre es im Labor kälter gewesen, wäre der Versuch misslungen. Bei Natrium-Ammonium-Tartrat tritt spontane Spaltung nur oberhalb von etwa 18 °C auf (Kristallisation als Konglomerat), darunter wäre nur eine Sorte Kristalle entstanden - die racemische Verbindung. Wesentliche frühe Beiträge zum Verständnis der Thermodynamik von Enantiomerengemischen leistete der niederländische Physikochemiker Hendrik Willem Bakhuis Roozeboom (1854−1907).[8]
Kristallisation
Man unterscheidet drei verschiedene Arten, in denen ein Racemat kristallisieren kann. Dies hat besonders Auswirkungen auf Racematspaltungen durch Kristallisation. H. W. B. Roozeboom hat bereits 1899 klar definiert, wie man zwischen diesen Arten unterscheiden kann.
Racemische Verbindung
Ein kristallines Racemat, das eine einzige Phase bildet, in welcher die zwei Enantiomere wohlgeordnet in einem 1:1 Verhältnis in der Elementarzelle vorkommen, wird racemische Verbindung genannt. Die Mehrheit aller chiralen Verbindungen kristallisiert auf diese Weise.
Konglomerat
Ein Konglomerat (racemisches Gemisch) ist ein kristallines Racemat, das aus einer 1:1-Mischung aus separaten Kristallen der reinen Enantiomere besteht. Die Elementarzellen jedes einzelnen Kristalls bestehen also entweder ausschließlich aus dem (+)-Enantiomer oder aus dem (–)-Enantiomer. Dieser kristalline Typ kommt seltener vor als die racemische Verbindung.[9]
Pseudoracemat
Dies ist ein kristallines Racemat, in dem die beiden Enantiomere Mischkristalle bilden[10], die Enantiomere im Kristallgitter also statistisch verteilt sind. Ungleiche Mengen beider Enantiomere können in jedem Verhältnis cokristallisieren. Nur sehr wenige chirale Verbindungen kristallisieren auf diese Weise.
Racematspaltung
Als Racematspaltung werden Verfahren zur Trennung von Racematen in ihre Enantiomere bezeichnet. Die Auftrennungsprinzipien sind:
Trennung als Enantiomere
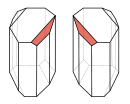
- manuelles Sortieren von separat gewachsenen Kristallen. Die klassische Methode nach Louis Pasteur, die allerdings praktisch unbedeutend ist, ist das manuelle Aussortieren von Kristallen unter dem Mikroskop. Eine Voraussetzung dafür ist, dass das Racemat von sich aus Kristalle bildet, die nur eines der Enantiomere enthalten (spontane Spaltung). Solche Kristalle unterscheiden sich auch makroskopisch wie Bild und Spiegelbild.
- Trennung von Racematen durch Animpfen übersättigter Racemat-Lösungen mit einer geringen Menge eines Enantiomers des gleichen Racemates und anschließende fraktionierende Kristallisation.[11]. Voraussetzung für diese Trennmethode: Kristallisation als Konglomerat. Mittlerweile ist jedoch ein Prozess zur Trennung verbindungsbildener Systeme erforscht.
- Komplexbildung mit (enantioselektiven) Rezeptoren
Trennung nach Diastereomerenbildung
- Chromatographie mit einer enantioselektiven Phase[12]
- Bildung diastereomerer Salze durch Zugabe eines enantiomerenreinen Hilfsstoffes und anschließende Trennung durch fraktionierende Kristallisation unter Ausnutzung ihrer unterschiedlichen physikalischen Eigenschaften[13]
- Die im organisch-chemischen Labor übliche Methode ist das in Kontakt bringen mit chiralen Materialien. Chromatographisch wählt man dazu entweder die mobile (Eluenz) oder die stationäre Phase optisch aktiv. Das führt zur unterschiedlichen Retention zweier Enantiomere. Auch eine dünnschichtchromatographische Enantiomerentrennung unter Verwendung einer enantioselektiven stationären Phase ist bekannt.
Fermentative Racematspaltung
- erstmals demonstriert wurde dieses Verfahren ebenfalls durch Pasteur 1858, der den Schimmelpilz Penicillium glaucum mit racemischer Weinsäure als Nährstoff wachsen ließ. Während das eine Enantiomer vom Pilz verstoffwechselt wurde, blieb das andere Enantiomer in der Lösung zurück.[14]
Kinetische Racematspaltung
- Eine weitere Methode ist die kinetische Racematspaltung. Dabei wird eine racemische Substanz mit einem enantiomerenreinen Reagenz zusammen gebracht, wobei ein Enantiomer schneller reagiert als das andere. Ist der Unterschied in der Reaktionsgeschwindigkeit groß genug, bleibt ein Enantiomer unverändert zurück, das andere Enantiomer wird in eine neue (evtl. ebenfalls chirale) Verbindung überführt. Dieses Trennprizip macht man sich z. B. bei der enzymatischen Racematspaltung mit Hydrolasen zu nutze. Die häufiger angewendete Art der kinetischen Racematspaltung bedient sich der Katalyse, bei der anstelle eines Reagens ein enantiomerenreiner Katalysator verwendet wird, der ein Enantiomer des Edukts schneller umsetzt als das andere.
- indirekte Prinzipien: a) temporäres kovalentes Binden an Hilfsstoffe oder b) asymmetrische Synthese innerhalb einer Syntheseroute.
Siehe auch
- Chiralität
- Mischkristall
- nichtracemisches Enantiomerengemisch
Weblinks
- Quarks & Co.: Racematspaltung durch Pasteur
Quellen und Anmerkungen
- ↑ Weitere einfach zu verstehende Beispiele für Links und Rechts in der Natur und anderswo siehe in: Henri Brunner: Rechts oder links – in der Natur und anderswo, Wiley-VCH Verlag GmbH, Weinheim 1999 (ISBN 3-527-29974-2), sowie in Brunners „chiraler Galerie“.
- ↑ gleich, bezüglich ihres Betrags.
- ↑ Ernst Mutschler: Arzneimittelwirkungen, 5. Auflage, Wissenschaftlichen Verlagsgesellschaft Stuttgart, 1986, S. 277, ISBN 3-8047-0839-0.
- ↑ E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology, European Journal of Clinical Pharmacology 26 (1984) 663-668.
- ↑ Bernard Testa, Pierre-Alain Carrupt, Joseph Gal: The so-called ldquointerconversionrdquo of stereoisomeric drugs: An attempt at clarification. In: Chirality. 5, Nr. 3, 1993, S. 105–110, doi:10.1002/chir.530050302.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Hermann J. Roth, Christa E. Müller und Gerd Folkers: Stereochemie & Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, ISBN 3-8047-1485-4, S. 161–162.
- ↑ Louis Fieser, Mary Fieser: Organische Chemie, Verlag Chemie Weinheim, 2. Auflage, 1972, S. 82−83, ISBN 3-527-25075-1.
- ↑ Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, S. 162−167, ISBN 3-527-25935-X.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Axel Kleemann und Jürgen Martens: Optical Resolution of Racemic S-(Carboxymethyl)cysteine, Liebigs Annalen der Chemie 1982, 1995−1998.
- ↑ Kurt Günther, Jürgen Martens und Maren Schickedanz: Dünnschichtchromatographische Enantiomerentrennung mittels Ligandenaustausch, Angewandte Chemie 96 (1984) 514-515; Angewandte Chemie International Edition in English 23 (1984) 506.
- ↑ Bernd Schäfer: Naturstoffe der chemischen Industrie, Elsevier GmbH, Spektrum Verlag, 2007, Seite 155, ISBN 978-3-8274-1614-8.
- ↑ Pasteur, M. L. (1858): C. R. Hebd. Seances Acad. Sci. Bd. 46, S. 615-618.
Wikimedia Foundation.