- Endergonisch
-
Chemische Reaktionen werden in Bezug darauf, ob sie innere Energie abgeben oder aufnehmen, als exergone oder endergone Reaktionen bezeichnet.
Exergone Reaktionen
Reaktionen, die spontan ablaufen, werden als exergon bzw. „exergonisch“ bezeichnet. Eine Reaktion ist dann exergon, wenn in deren Verlauf die freie Enthalpie G abnimmt,also wenn ΔG ein negatives Vorzeichen hat (Gegenteil: endergon; siehe unten).
ΔG < 0 exergon
ΔG > 0 endergonΔG ist gegeben durch folgende Beziehung (oft auch als Gibbs-Helmholtz-Gleichung bezeichnet):
- ΔG = Änderung der freien Enthalpie/ Gibbs-Energie
- ΔH = Änderung der Reaktionsenthalpie
- ΔS = Entropieänderung
Systeme streben stets dem Gleichgewichtszustand zu, weil hier die freie Enthalpie G den minimalen Wert (besser Betrag) annimmt. Hat ein System sein Gleichgewicht erreicht, verändern sich die Konzentrationen der Reaktionspartner nicht mehr, weil G auf keinem Weg weiter verringert werden kann, und es gilt ΔG = 0.
Endergone Reaktionen
Endergone Reaktionen laufen nicht freiwillig ab, ΔG hat ein positives Vorzeichen. Beispiel für einen endergonen Prozess: Die Entstehung eines Proteins in einer wässrigen Lösung von Aminosäuren. Diese Reaktion kann nur dann realisiert werden, wenn sie an andere, exergone Prozesse gekoppelt wird, so dass in der Summe das Vorzeichen von ΔG schließlich negativ ist; in biologischen Systemen gelingt dies meist durch die Hydrolyse von ATP.
Da die Rückreaktion einer endergonen Reaktion stets exergon ist (und umgekehrt), sollten Proteine eigentlich spontan wieder in ihre Aminosäuren zerfallen. Allerdings ist die Geschwindigkeit der Zerfallsreaktion unter physiologischen Bedingungen so klein, dass sie vernachlässigt werden kann, das heißt Peptidbindungen sind in diesem Fall metastabil. Hier entscheidet also ein Argument aus der Reaktionskinetik.
ΔG kann mit Hilfe tabellierter Werte (Standardreaktionsentropien
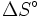 und Standardreaktionsenthalpien
und Standardreaktionsenthalpien 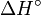 ) relativ einfach für Standardbedingungen berechnet werden. Man spricht dann von Freier Standardreaktionsenthalpie
) relativ einfach für Standardbedingungen berechnet werden. Man spricht dann von Freier Standardreaktionsenthalpie 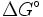 . Diese bezieht sich auf Konzentrationen von 1 mol/L für alle Reaktionspartner und eine Temperatur von 25° C.
. Diese bezieht sich auf Konzentrationen von 1 mol/L für alle Reaktionspartner und eine Temperatur von 25° C.Deutung von
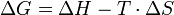
- Dies ist keine Herleitung der Gibbs-Helmholtz-Gleichung!
Triebkraft für das Ablaufen einer chemischen Reaktion ist die Zunahme der Entropie S im Universum (vgl. 2. Hauptsatz der Thermodynamik).
Betrachtet man ein System, das keine Wärme mit der Umgebung austauschen kann (adiabatisches System), so lautet die einzige Bedingung, die an einen spontan ablaufenden, also einen exergonen Vorgang zu stellen ist, ΔSSystem > 0.
Erlaubt man dem System den Wärmeaustausch mit der Umgebung (diabatisches System), muss zusätzlich die Entropieänderung in der Umwelt berücksichtigt werden. Diese kann erfasst werden über die Enthalpieänderung des Systems ΔH:
- Als negativer Beitrag, wenn die Reaktion exotherm ist, thermische Energie an die Umgebung verteilt wird und auf diese Weise in der Umwelt die Entropie zunimmt,
- als positiver Beitrag, wenn die Reaktion endotherm verläuft und die Entropie in der Umwelt abnimmt, weil thermische Energie im Reaktionsgefäß konzentriert wird.
Das System strebt Zustände mit minimaler freien Enthalpie G an, da diese gleichzeitig für System und Umgebung Zustände maximaler Entropie sind.
Wikimedia Foundation.
