- Entstehungsgeschichte des Periodensystems der Elemente
-
Die Entwicklung des Periodensystems der Elemente hat folgende Geschichte:
Inhaltsverzeichnis
Johann Wolfgang Döbereiner (Triadensystem)
Johann Wolfgang Döbereiner verglich zwischen 1817 und 1829 die Eigenschaften chemischer Elementen, ohne die eigentliche innere Struktur von Atomen zu kennen. Am 16. Juli 1817 erwähnte er in einem Brief an Hofrat Ferdinand Wurzer zum ersten Mal die Bezeichnung Triaden für sein in Entwicklung befindliches System[1]. Döbereiner hatte bemerkt, dass die Atommassen (damals „Atomgewichte“) der drei einander ähnlichen Elemente Barium (137,327 u), Strontium (87,62 u), und Calcium (40,078 u) den Mittelwert 88,5 u ergaben, also den ungefähren Wert von Strontium. Diese Erkenntnis ließ Döbereiner daran zweifeln, dass Strontium ein eigenständiges Element ist; er vermutete stattdessen eine Mischung aus Calcium und Barium, was sich allerdings später als falsch herausstellte.
Im Jahre 1829 veröffentlichte Döbereiner eine Schrift mit dem Namen Versuch zu einer Gruppierung der elementaren Stoffe nach ihrer Analogie und somit das erste wissenschaftlich fundierte Ordnungssystem der chemischen Elemente. Es gelang ihm 30 von damals 53 bekannten Elementen mit Hilfe des Triadensystems einzuordnen. Vertikale Triaden: die Alkalien (Lithium, Natrium, Kalium), die alkalischen Erden (Calcium, Strontium, Barium), die Salzbildner (Chlor, Brom, Iod) und die Säurebildner (Schwefel, Selen, Tellur). Fluor würde sich problemlos mit in die Triade der Salzbildner einordnen lassen. Laut Döbereiner sollte es aber das erste Glied einer Triade bilden, von welcher die anderen beiden Elemente noch nicht entdeckt waren. Wasserstoff, Sauerstoff, Stickstoff und Kohlenstoff wurden von Döbereiner isoliert betrachtet, obwohl Sauerstoff, Stickstoff und Kohlenstoff eine akzidentelle Triade bilden würden. Weiterhin gelang es ihm nicht, die Erdmetalle und die Elemente Cadmium, Antimon, Bismut, Gold, Wolfram und Tantal in Triaden einzuordnen. Die Platinmetalle bilden zwei Triaden, Platin, Iridium, Osmium und Palladium, Rhodium, Pluran. Die Existenz des Elementes Pluran wurde bereits zu Döbereiners Zeiten von Johann Christian Poggendorff angezweifelt. Johann Wolfgang Döbereiner legte mit der Triadenregel den Grundstein für die Entwicklung des Periodensystems.
Döbereiner erstellte Gruppen von jeweils drei Elementen, die sogenannten „Triaden“:
Element Atommasse Dichte Element Atommasse Dichte Cl 35,5 1,56 g/l Ca 40,1 1,55 g/cm³ Br 79,9 3,12 g/l Sr 87,6 2,6 g/cm³ I 126,9 4,95 g/l Ba 137 3,5 g/cm³ Das Triadensystem Döbereiners wurde in den darauffolgenden Jahren u. a. von Leopold Gmelin (neue Triaden) und von Ernst Lenßen erweitert. Lenßen legte nur das Atomgewicht der Elemente zu Grunde und ließ die anderen Eigenschaften außen vor (akzidentelle Triaden). Auf diese Weise konnte er 1857 alle damals bekannten Elemente nach dem Triadenprinzip einordnen.
J. A. R. Newlands (Gesetz der Oktaven)
John Alexander Reina Newlands fand 1864 heraus, dass sich bei der Ordnung der Elemente nach jeweils 8 die chemischen Eigenschaften wiederholen, was er mit den Oktaven aus der Musik verglich. Er nannte seine Entdeckung Gesetz der Oktaven.
Siehe auch: Alexandre-Emile Béguyer de Chancourtois
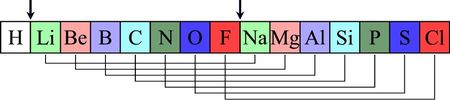
Die Edelgase waren J. A. R. Newlands noch nicht bekannt.Dimitri Mendelejew und Lothar Meyer (Periodensystem)
1869 stellten fast zeitgleich und unabhängig voneinander der deutsche Chemiker Lothar Meyer und der russische Chemiker Dimitri Mendelejew das erste Periodensystem vor. Nach diesem Ordnungsprinzip wurden die bekannten Elemente nach steigender Atommasse und nach Verhaltensähnlichkeit in verschiedenen Intervallen untereinander angeordnet.
Ihre Theorie ging bereits soweit, dass sie zum Teil von der strengen Ordnung abwichen und einige Stellen frei ließen, weil ihnen die Anordnung der gemeinsamen Eigenschaften in Gruppen wichtiger war. Für die freien Stellen postulierten sie die Existenz von bisher noch unbekannten Elementen. Problematisch war, dass es Abweichungen in der Reihenfolge bei einigen Elementen gab, sodass diese ausgetauscht werden mussten. Es handelte sich dabei um folgende Elemente: Argon – Kalium, Cobalt – Nickel und Tellur – Iod.
Dieses Vorgehen wurde später durch die Entdeckung der atomaren Strukturen untermauert. Durch das Orbitalmodell wurde auch endlich eine befriedigende Erklärung für die Periodizität geliefert. In Russland wird im Gedenken an Mendelejew auch heute noch das Periodensystem als Tabliza Mendelejewa bezeichnet.
Entdeckung vorhergesagter Elemente
Mendelejew sagte 1871 die Existenz von drei Elementen vorher, weil diese entsprechende Lücken in seinem Periodensystem ausfüllen würden. Aus diesem Grunde „erfand“ er die Vorsilbe Eka (sanskr. = eins) und bezeichnete diese Elemente mit Ekasilizium, Ekaaluminium und Ekabor nach dem ihnen am nächsten stehenden bekannten Element.
- Ekaaluminium 1875 von Paul Emile Lecoq de Boisbaudran entdeckt und nach Frankreich als Gallium bezeichnet.
- Ekabor 1879 von Lars Fredrik Nilson entdeckt und nach Skandinavien als Scandium bezeichnet.
- Ekasilizium 1886 von Clemens Winkler entdeckt und nach Deutschland als Germanium bezeichnet.
Henry Moseley (Moseleysches Gesetz)
H.G.J. Moseley entdeckte 1913 das Moseleysche Gesetz, in dem ein Zusammenhang zwischen der Ordnungszahl eines Elementes und der Frequenz einer Spektrallinie der charakteristischen Röntgenstrahlung formuliert ist.
Moseley lieferte mit seinem Gesetz eine Bestätigung für die Richtigkeit der Ordnung der Elemente im Periodensystem und konnte gleichzeitig die exakte Anzahl der damals noch unbekannten Elemente vorhersagen.
Einzelnachweise
- ↑ Biographisch-Litheratisches Handwörterbuch zu Geschichteder exacten Wissenschaften, J. C. Poggendorf, Verlag Johann Ambrosius Barth, Leipzig 1863, Bd. II, S, 1377.
Weblinks
Wikimedia Foundation.




