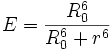- FRET
-
Der Fluorescence resonance energy transfer (kurz FRET) ist ein 1946 von Theodor Förster entdeckter physikalischer Prozess, bei dem Energie eines angeregten Fluoreszenzfarbstoffs (Donor-Fluorophor) strahlungsfrei auf einen zweiten Fluoreszenzfarbstoff (Akzeptor-Fluorophor) übertragen werden kann. Der Fluorescence resonance energy transfer ist, wie beispielsweise auch der Bioluminescence resonance energy transfer (BRET), eine Variante des Förster resonance energy transfers. Da die Intensität des FRET unter anderem vom Abstand dieser beiden Fluorophore abhängt, hat sich die Nutzung von FRET als "optisches Nanometermaß" insbesondere in der Biochemie und der Zellbiologie etabliert.
Inhaltsverzeichnis
Physikalisches Prinzip
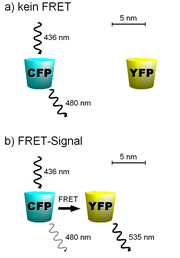
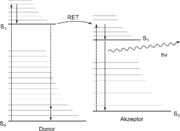
FRET kann zwischen zwei Farbstoffen, die zur Fluoreszenz befähigt sind, beobachtet werden. Dabei wird die Energie eines angeregten Donor-Fluorophors nicht in Form von Fluoreszenz abgegeben, sondern strahlungslos über Dipol-Dipol-Wechselwirkungen auf einen fluoreszierenden Akzeptor übertragen. FRET kann somit über eine Abnahme der Donor-Fluoreszenz oder eine Zunahme der Akzeptorfluoreszenz detektiert werden.
Um eine strahlungsfreie Energieübertragung auf das Akzeptor-Molekül via FRET zu ermöglichen, müssen verschiedene Kriterien erfüllt sein:
- Spektrum: Das Emissionsspektrum des Donors muss mit dem Absorptionsspektrum des Akzeptors überlappen.
- Schwingungsebenen: Donor und Akzeptor müssen parallele elektronische Schwingungsebenen haben.
- Abstand: Donor und Akzeptor sollten nur wenige Nanometer voneinander entfernt sein.
Spektren
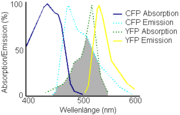
Um eine Energieübertragung zu ermöglichen, muss das Emissionsspektrum des Donors mit dem Absorptionsspektrum des Akzeptors überlappen. Dieses Kriterium wird besonders gut von dem Fluorophorenpaar zyan fluoreszierendes Protein (CFP) – gelb fluoreszierendes Protein (YFP) erfüllt. Weitere wichtige in der Biochemie genutzte Fluorophorenpaare sind grün fluoreszierendes Protein (GFP) – Rhodamin, Fluoresceinisothiocyanat – Cy3, FlAsH – CFP und Europium (Eu3+) – Allophycocyanin. Auch die endogen in Proteinen vorkommenden schwach fluoreszierenden Aminosäuren Tyrosin und Tryptophan lassen sich als FRET-Fluorophore nutzen.
Aus der Größe der überlappenden Fläche der beiden Spektren lässt sich die maximale FRET-Effizienz für das jeweilige Donor-Akzeptorpaar berechnen.
Schwingungsebenen
Donor und Akzeptor müssen parallele elektronische Schwingungsebenen haben. Für die Untersuchung von Prozessen in Lösung spielt dieses Kriterium keine nennenswerte Rolle, da es aufgrund der Molekülbewegung und -schwingung in der Regel erfüllt wird. Sind hingegen Donor und Akzeptor fixiert (z.B. am selben Protein), so kann eine Änderung des FRET-Signals Aufschluss über die Änderung der Schwingungsebenen und damit der Lage beider Fluorophore zueinander geben.
Abstand
Donor und Akzeptor sollten nur wenige Nanometer von einander entfernt sein, da die Intensität des FRET-Signals mit der 6. Potenz des Abstands beider Fluorophore r abnimmt. Die Effizienz des Energietransfers E ist ebenso vom Förster-Radius R0 des Fluorophorenpaars abhängig:
Der Förster-Radius ist dabei der Abstand zwischen beiden Fluorophoren, bei dem die Energieübertragung zu 50 % erfolgt. Im Falle des Fluorophorenpaars CFP – YFP beträgt der Förster-Radius 4,9 nm. Das Kriterium des geringen Abstandes zwischen Donor und Akzeptor führt dazu, dass FRET oft als "optisches Nanometermaß" bezeichnet wird. Daher hat sich FRET in der Biochemie als eine wertvolle Methode etabliert.
Messung
 Beispiel: Position des ARF-Enzyms innerhalb des Golgi-Apparats von Makrophagen
Beispiel: Position des ARF-Enzyms innerhalb des Golgi-Apparats von MakrophagenEs gibt verschiedene Methoden FRET indirekt nachzuweisen und die FRET-Effizienz zu messen. FRET kann klassisch in einem Fluoreszenzmikroskop oder einem Fluorimeter indirekt nach Anregung des Donors detektiert werden, da FRET sich zum einen in einer reduzierten Emissionsintensität des Donor-Fluorophors und entsprechend einer erhöhten Emissionsintensität des Akzeptors (sensitized emission) äußert. Aus den gemessenen Fluoreszenz-Intensitäten von Donor und Akzeptor kann der Abstand der beiden Fluorophore berechnet werden.
In einem Fluoreszenzmikroskop kann die FRET-Effizienz bestimmt werden, indem FRET durch selektives Ausbleichen des Akzeptors unterbindet. Aus den Fluoreszenzintensitäten des Donors vor und nach dem Ausbleichen des Akzeptors kann die FRET-Effizienz berechnet werden (acceptor photobleaching FRET oder donor unquenching).
Auch die Fluoreszenzlebenszeiten von Akzeptor und Donor zeigen typische Veränderungen. So wird die Fluoreszenzlebenszeit des Donors durch FRET deutlich verkürzt. Die Fluoreszenzlebensdauer des Akzeptors dagegen wird durch das Auftreten eines zeitlich auflösbaren Anregungsprozesses verzerrt. Wird in einem zeitaufgelösten Fluorometer die Fluoreszenzlebenszeit von Donor oder Akzeptor bestimmt, kann daraus der Abstand der beiden Fluorophore berechnet werden.
Anwendung
FRET wird als ein modernes Werkzeug in der Biochemie, Molekularbiologie und Zellbiologie zum Nachweis von Protein-Protein-, Protein-Nukleinsäure- und Nukleinsäure-Nukleinsäure-Wechselwirkungen verwendet. Außer für spektroskopische Untersuchungen wird FRET hierbei in Verbindung mit der Fluoreszenzmikroskopie und der Konfokalmikroskopie genutzt.
Beim Betrieb Organischer Halbleiter als aktives Material in Lasern oder LEDs spielt FRET (dort oft auch einfach "Förstertransfer" genannt) eine entscheidende Rolle. Durch die im Wellenlängenbereich nicht zwangsläufig deckungsgleichen Spektren von Emission und Absorption entsteht "von selbst" ein 4-Niveau-System, wie es für Laser benötigt wird. Gleichzeitig wird eine günstige Auskopplungssituation erreicht, da das emittierte Licht weniger stark reabsorbiert wird.
Nachweis der Interaktion von Proteinen
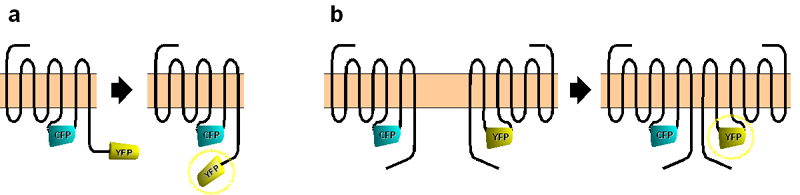
FRET kann als Werkzeug in der Biochemie verwendet werden um Interaktionen zwischen zwei Proteinen nachzuweisen. Im Idealfall kann sogar der Abstand zwischen den Proteinen genau bestimmt werden. Hierzu wird an das erste Protein ein Donorfluorophor und an das zweite Protein ein Akzeptorfluorophor gebunden. Sind die Grundvoraussetzungen für einen Energietransfer erfüllt (z.B. überlappenden Emissions-/Absorptionsspektren, parallele Schwingungsebenen etc., siehe oben), so kann ein FRET-Signal beobachtet werden, das je nach Abstand der beiden modifizierten Proteine variiert. Je näher die Moleküle zueinander liegen, desto höher ist die FRET-Effizienz.
Anwendungsbeispiele für FRET in der Biochemie sind der Nachweis der Interaktion, Homo- und Heterodimerisierung (bzw. -oligomerisierung) von Proteinen sowie die Aufklärung von Signaltransduktionswegen. Auch die Vermessung von Konformationsänderungen von Proteinen ist möglich, wenn Donor- und Akzeptorfluorophor an dasselbe Molekül gekoppelt sind.
Konzentrationsbestimmung von Nukleinsäuren
In der Molekularbiologie findet FRET bei der Quantifizierung von Nukleinsäuren mit Hilfe der Real time quantitative PCR Anwendung. Zu diesem Zweck werden zwei in Überschuss zugesetzte und mit Donor- und Akzeptorfluorophoren markierte Oligonukleotide als Hybridsonden (LightCycler®-Sonden) eingesetzt, die spezifisch an die DNA während eines PCR-Zyklus binden. Die Bindung der Hybridsonden an die DNA und die damit verbundene Annäherung der Sonden ermöglicht einen FRET. Das FRET-Signal nimmt dabei in Abhängigkeit von der DNA-Konzentration zu.
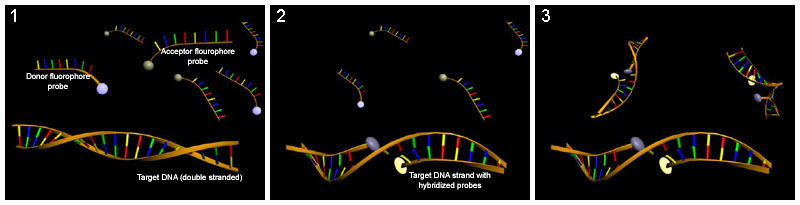 Quantifizierung von Nukleinsäuren mit Hilfe der Real time PCR und LightCycler®-Sonden. (1) Einsatz von LightCycler®-Sonden, die mit 2 verschiedenen FRET-Fluorophoren markiert wurden. (2) Während eines PCR-Zyklus hybridisieren die Sonden mit dem komplementären DNA-Strang und ermöglichen somit eine Fluoreszenz des Akzeptors. (3) Die Akzeptor-Fluoreszenz steigt proportional mit der Konzentration komplementärer DNA.
Quantifizierung von Nukleinsäuren mit Hilfe der Real time PCR und LightCycler®-Sonden. (1) Einsatz von LightCycler®-Sonden, die mit 2 verschiedenen FRET-Fluorophoren markiert wurden. (2) Während eines PCR-Zyklus hybridisieren die Sonden mit dem komplementären DNA-Strang und ermöglichen somit eine Fluoreszenz des Akzeptors. (3) Die Akzeptor-Fluoreszenz steigt proportional mit der Konzentration komplementärer DNA.Literatur
- Theodor Förster: Zwischenmolekulare Energiewanderung und Fluoreszenz, Ann. Physik 6(2):55, 1948. http://dx.doi.org/10.1002/andp.19484370105
- Joseph R. Lakowicz: Principles of Fluorescence Spectroscopy. Plenum Publishing Corporation, 2. Ausgabe, 1999.
Wikimedia Foundation.