- Aktionspotenzial
-
Das Aktionspotential (auch elektrische Erregung oder Nervenimpuls) beschreibt eine vorübergehende, charakteristische Abweichung des Membranpotentials einer biologischen Zelle von ihrem Ruhemembranpotential. Während des Aktionspotentials ändert sich die elektrische Potentialdifferenz an den Zellmembranen. Da auch viele Pflanzen- und Pilzzellen elektrisch erregbar sind, ist der evolutionäre Ursprung von Aktionspotentialen bei gemeinsamen, einzelligen Vorfahren von Tier-, Pflanzen- und Pilzzellen zu vermuten, die Aktionspotentiale wahrscheinlich zur Osmoregulation einsetzten.
Bei Tieren sind Aktionspotentiale osmotisch neutral und dienen der schnellen Signalübertragung durch spezialisierte Zellen. Dazu gehören Neurone (Nervenzellen) und Muskelzellen. Die Signalfunktion von Aktionspotentialen bei manchen Gefäßpflanzen (beispielsweise Mimose – auch mit osmo-elektrischer Koppelung) ist eine davon unabhängige, evolutionäre Errungenschaft.
Aktionspotentiale können weitgehend verlustfrei und unverzerrt über größere Entfernungen geleitet werden. Sie ermöglichen bei Tieren die Erregungsleitung im Nervensystem und die Kontraktion der Muskulatur.
Inhaltsverzeichnis
Cytologische Grundlagen
Die Ursachen für die Ausbildung und die besonderen Eigenschaften eines Aktionspotentials sind auf die Eigenschaften verschiedener Gruppen von Ionenkanälen in der Plasmamembran der Zelle zurückzuführen. Ein anfänglicher Reiz aktiviert, sobald er eine bestimmte Schwelle erreicht (ca. −50 mV), und ohne Rücksicht darauf, wie weit er sie übersteigt, eine Kette von Öffnungs- und Schließungsvorgängen der Kanäle, die einen Ionenstrom ermöglichen und damit das Membranpotential verändern. Die Form des Aktionspotentials ist damit, unabhängig von der Stärke des auslösenden überschwelligen Reizes, immer gleichförmig (Alles-oder-nichts-Gesetz). Diese Änderung des Potentials kann an der nächsten Stelle der Membran wieder als Reiz dienen, was die Grundlage der Reizfortleitung ist.
Beschreibung des Potentialverlaufs
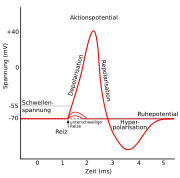
Ausgehend vom Ruhemembranpotential, das bei Neuronen je nach Zelltyp typischerweise zwischen −90 und −70 mV liegt, werden vier Phasen des Aktionspotentials unterschieden:
- In der Initiationsphase erfolgt, ausgelöst durch einen passenden Reiz, die Anhebung der Spannung bis zum Schwellenpotential, das für die Auslösung eines Aktionspotentials überschritten werden muss. Der Reiz kann die sich ausbreitende Potentialänderung durch ein Aktionspotential am benachbarten Membranabschnitt sein, oder ein Ioneneinstrom durch Kanäle an einer chemischen Synapse.
- Die Depolarisation ist der steile Aufstieg der Kurve bis in den positiven Bereich. Den ersten sehr steilen Abschnitt bezeichnet man als Aufstrich, die Potentialumkehr bis zu einem Bereich zwischen +20 und +30 mV ins Positive als Overshoot. Während der Depolarisation ändert sich das Membranpotential von negativen hin zu positiven Werten.
- Der anschließende Abfall in Richtung des Ruhepotentials ist die Repolarisation.
- Der letzte Abschnitt wird als Hyperpolarisation oder als hyperpolarisierendes Nachpotential bezeichnet. Dort fällt die Spannung auf einen Wert von −90 mV bevor sie sich durch eine weitere Repolarisation wieder auf dem Niveau des Ruhepotentials einpegelt.
Die Dauer eines Aktionspotentials beträgt ca. 1–2 ms (in Neuronen), kann aber auch bis zu einigen hundert Millisekunden (im Herzen) betragen.
Bereits während der Repolarisation befindet sich die Zelle in der Refraktärphase. Während dieser Phase kann zunächst kein (absolute Refraktärzeit, ca. 0,5 ms) und dann nur mit erhöhtem Reiz (erhöhtes Schwellenpotential innerhalb der relativen Refraktärzeit, ca. 3,5 ms) ein weiteres Aktionspotential erzeugt werden.
Ursachen des Aktionspotentials
Die Erklärung setzt das Verständnis der im Artikel zum Ruhemembranpotential vorgestellten Entstehung eines Ruhepotentials durch Ionenkanäle, Ionenströme und das Kaliumgleichgewichtspotential voraus.
Eigenschaften der Ionenkanäle
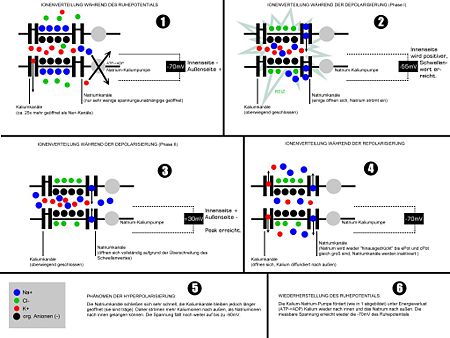
Wie schon im Artikel über das Ruhemembranpotential beschrieben, verfügen Zellen über eine Reihe von Ionenkanälen. Für das Aktionspotential sind vor allem bestimmte für Natrium- bzw. Kalium-Ionen spezifische Ionenkanäle verantwortlich. Diese Kanäle öffnen sich in Abhängigkeit vom Membranpotential, d. h. sie sind spannungsaktiviert. In Ruhe ist das Membranpotential negativ.
So ist beispielsweise ein spannungsabhängiger Natriumkanal (Nav-Kanal) (aufgrund seiner Eigenschaft auch als schneller Natriumkanal bezeichnet) beim Ruhemembranpotential geschlossen und aktivierbar. Bei Depolarisation über einen kanalspezifischen Wert erfolgt eine Konformationsänderung. Der Kanal wird dadurch durchlässig für Ionen und geht in den Zustand offen über. Der Kanal bleibt aber trotz anhaltender Depolarisation nicht offen, sondern wird innerhalb weniger Millisekunden unabhängig vom Membranpotential wieder geschlossen. Das geschieht meist durch einen im Zytoplasma liegenden Teil des Kanalproteins, die Inaktivierungsdomäne, die sich gleich einem „Stöpsel“ in den Kanal setzt und diesen verstopft. Diesen Zustand bezeichnet man als geschlossen und inaktiviert. Der Übergang in den Zustand geschlossen und aktivierbar ist nur nach einer Hyperpolarisation (oder vollständiger Repolarisation bei Herzmuskelzellen) möglich, der Übergang vom Zustand geschlossen und inaktiviert zum Zustand offen ist im vereinfachten Modell nicht möglich.
In der Literatur wird auch beschrieben, dass ein geschlossener und inaktivierter Kanal nach Repolarisierung zunächst kurzzeitig im Zustand offen vorliegt, bevor er durch die Konformationsänderung direkt nach geschlossen aktivierbar übergeht. In jedem Fall erfolgt die Wiederaktivierung nur nach einer Hyperpolarisation (oder vollständiger Repolarisation bei Herzmuskelzellen), ein Übergang inaktiviert nach offen ist bei depolarisierter Membran nicht möglich.
Nicht alle Kanäle öffnen sich gleichzeitig bei ein und demselben Wert des Membranpotentials. Vielmehr ist die Wahrscheinlichkeit eines Kanals, in einen bestimmten Zustand überzugehen, spannungsabhängig. Aus der rein statistischen Verteilung stellt sich ein Gleichgewicht ein, so dass eine größere Zahl von Kanälen in der Summe sehr gut das oben geschilderte Modell erfüllt.
Auch ist der Zeitaufwand, um von einen Zustand in den anderen überzugehen, kanalspezifisch. Im geschilderten Natriumkanal läuft die Konformationsänderung von geschlossen nach offen in weniger als einer Millisekunde ab, während ein vergleichbarer Kaliumkanal Zeit in der Größenordnung von 10 ms benötigt.
Abgesehen von der Spannung gibt es noch eine Reihe weiterer Mechanismen zum Öffnen bzw. Schließen der Kanäle. Für das Aktionspotential sind davon nur noch zwei von gewisser (siehe unten) Bedeutung. Zum einen sind die Kalium-einwärts-gleichgerichteten-Kanäle Kir zwar an sich nicht regelbar. Es gibt jedoch niedermolekulare, positiv geladene Stoffe wie das Spermin, die bei ausreichender Depolarisation die Kanalporen verstopfen können (Kanalblock, Porenblock). Ein weiterer Mechanismus betrifft Kaliumkanäle, die öffnen, wenn intrazellulär Calciumionen (normalerweise intrazellulär in sehr niedriger Konzentration) an sie binden.
Ablauf des Aktionspotentials
Ausgangslage
In der Ausgangslage befindet sich die Zelle in Ruhe und weist ihr Ruhemembranpotential auf. Die Natriumkanäle sind geschlossen, nur bestimmte Kaliumkanäle sind geöffnet, die Kaliumionen bestimmen das Ruhemembranpotential. Bei allen Ionenbewegungen wird Richtung und Stärke durch die elektrochemischen Triebkräfte für die jeweiligen Ionen bestimmt. Vor allem Natriumionen haben die Tendenz, schnell in die Zelle zu strömen, wenn sich die Kanäle öffnen.
Initiationsphase
Während der Initiationsphase muss durch einen Reiz das Membranpotential abnehmen bis die Depolarisation einen bestimmten Schwellenwert erreicht. Das kann durch die Öffnung von postsynaptischen Ionenkanälen (Na+, Ca2+) oder durch ein elektrotonisch weitergeleitetes Aktionspotential aus einer nahen Membranregion geschehen.
Verringert sich das Membranpotential um 20 mV (beispielsweise von −70 auf −50 mV), tritt der Porenblock der Kir-Kanäle durch Spermin ein, was die nachfolgende sehr schnelle Depolarisation und das Erreichen des Schwellenwerts der Natriumkanäle ermöglicht, die sonst durch ausströmende Kaliumionen, die in Richtung des Ruhepotentials wirken würden, zumindest vermindert würden.
Aufstieg und Overshoot
Bei -60 mV fangen die spannungsabhängigen Natriumkanäle NaV an, in den offenen Zustand überzugehen. Natriumionen, deren Konzentration sehr weit von ihrem Gleichgewichtspotential entfernt ist, strömen ein, die Zelle depolarisiert, dadurch werden weitere Kanäle geöffnet, noch mehr Ionen können einströmen: Der schnelle Aufstieg führt zum Overshoot (Umpolarisierung).
Beginn der Repolarisation
Noch bevor das Potentialmaximum erreicht ist, beginnen die NaV-Kanäle zu inaktivieren. Zugleich kommen die spannungsabhängigen Kaliumkanäle KV ins Spiel; K+-Ionen strömen aus der Zelle heraus. Sie haben zwar ihre Schwelle bei ähnlichen Werten, brauchen aber wesentlich länger für das Öffnen, womit sie jetzt erst langsam beginnen. Während des Maximums der Na-Leitfähigkeit sind die Kaliumkanäle gerade erst zur Hälfte geöffnet und erreichen ihr Maximum, wenn fast alle Na-Kanäle schon inaktiviert sind. Dadurch liegt das Na-Maximum etwas vor dem Spannungsmaximum, während das K-Maximum in die Phase der steilsten Repolarisation fällt.
Repolarisation
Während der Repolarisation nähert sich das Potential wieder dem Ruhepotential an. Die KV schließen, der Porenblock der Kir wird aufgehoben, was wichtig für die Stabilisierung des Ruhepotential ist. Die NaV-Kanäle werden langsam wieder aktiviert.
Nachhyperpolarisation
In vielen Zellen (vor allem Neuronen) ist noch eine Hyperpolarisation zu beobachten. Sie erklärt sich durch eine auch weiterhin noch erhöhte Kaliumleitfähigkeit, wodurch das Potential noch näher am Kaliumgleichgewichtspotential liegt. Die Leitfähigkeit ist höher, weil während des Aktionspotentials eingeströmte Calciumionen entsprechende Kaliumkanäle öffnen, und normalisiert sich erst, wenn der Calciumspiegel wieder absinkt. Auch eine erhöhte Pumprate der Natrium-Kalium-ATPase kann einen Beitrag zur Hyperpolarisation leisten.
Refraktärzeit
Nach dem Abklingen des Aktionspotentials ist das Axon für eine kurze Zeit nicht mehr erregbar. Bei den Arbeitsmyokardzellen des Herzens ist diese Phase – dort auch „Plateauphase“ genannt – besonders lang, was auf den sog. „langsamen Calcium-Einstrom“ zurückgeführt wird (dieser Umstand ist wichtig, um ein „Zurücklaufen“ der Erregung zu verhindern (Unidirektionalität)). Diese Dauer, die Refraktärzeit, ist bestimmt durch die Zeit, die die NaV zur Wiederaktivierung benötigen. Während der absoluten Refraktärphase kurz nach dem Overshoot, wenn die Repolarisation noch im Gange ist, können diese Kanäle überhaupt nicht wieder öffnen. Man sagt auch, der Schwellenwert liegt bei Unendlich. Während der relativen Refraktärphase benötigt man stärkere Reize und erhält schwächere Aktionspotentiale. Hier bewegt sich der Schwellenwert von Unendlich wieder auf seinen normalen Wert zu.
Feuern
Das Auslösen eines Aktionspotentials wird mit Feuern anschaulich beschrieben. Erreicht ein Aktionspotential die Synapse, werden Transmitter „explosionsartig“ in den synaptischen Spalt abgegeben. Je mehr Aktionspotentiale hintereinander die Synapse erreichen, desto mehr Transmitterstoffe werden ausgeschüttet. Die Aussage „Neurone feuern“ wird sowohl populärwissenschaftlich als auch in wissenschaftlichen Beiträgen benutzt.
Schwellenpotential
Meist wird für die Auslösung eines Aktionspotentials das Überschreiten eines bestimmten Schwellenpotentials verantwortlich gemacht, ab dem die Natriumkanäle nach Art eines internen Vergleiches lawinenartig aktiviert werden. Trotz aller Bemühungen eine solche Feuerschwelle zu finden, kann kein fester Spannungswert angegeben werden, der ein Aktionspotential bedingt. Stattdessen feuern Neurone unter einem relativen breiten Band von auslösenden Membranspannungen. Daher ist die Neurowissenschaft von der Vorstellung eines festen Schwellenpotentials abgekommen. Systemtheoretisch lässt sich die Entstehung des Aktionspotentials am ehesten durch eine Bifurkation zwischen passiver und Aktionspotentialdynamik, wie es beispielsweise beim Hodgkin-Huxley-Modell der Fall ist, beschreiben. Trotzdem ist es, auch in der Fachliteratur, durchaus üblich, weiterhin von einer Feuerschwelle zu sprechen, um den grauen Bereich zwischen Ruhe und Aktionspotential zu kennzeichnen.
Besondere tierische Aktionspotentiale
Außer durch spannungsaktivierte Natriumkanäle können Aktionspotentiale im Herzmuskel oder in Purkinjezellen) durch spannungsaktivierte Calciumkanäle ausgelöst werden.
Pflanzliche Aktionspotentiale
Prinzipiell sind Zellen von Pflanzen und Pilzen[1] auch elektrisch erregbar. Der Hauptunterschied zum tierischen Aktionspotential besteht darin, dass die Depolarisierung nicht durch Eintritt von positiven Natriumionen geschieht, sondern durch Ausfluss von negativen Chloridionen [2] [3] [4]. Zusammen mit dem darauffolgenden Ausfluss von positiven Kaliumionen, der gleichermaßen in tierischen wie in pflanzlichen Zellen die Repolarisierung bewirkt, bedeutet dies für Pflanzenzellen einen osmotischen Verlust an Salz (KCl), wohingegen das tierische Aktionspotential durch gleiche Mengen von Natriumeinstrom und Kaliumausstrom in der Summe osmotisch neutral ist. Die Koppelung von elektrischen und osmotischen Ereignissen beim pflanzlichen Aktionspotential [5] legt nahe, dass elektrische Erregbarkeit bei den gemeinsamen, einzelligen Vorfahren von Tier- und Pflanzenzellen der Regulierung des Salzhaushalts unter veränderlichen Salinitätsbedingungen diente, während die osmotisch neutrale Fortleitung von Signalen durch tierische Vielzeller mit nahezu konstanter Salinität eine evolutionär jüngere Errungenschaft darstellt. [6]. Demnach hat sich die Signalfunktion von Aktionspotentialen in einigen Gefäßpflanzen (beispielsweise Mimosa pudica) unabhängig von derjenigen in tierischen Zellen herausgebildet.
Einzelnachweise
- ↑ Slayman CL, Long WS, Gradmann D: Action potentials in Neurospora crassa , a mycelial fungus. In: Biochimica et biophysica acta. 426, 1976, S. 737-744. PMID 130926
- ↑ Mummert H, Gradmann D: Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes. In: Journal of Membrane Biology. 124, 1991, S. 265-273. PMID 1664861
- ↑ Gradmann D: Models for oscillations in plants. In: Austr. J. Plant Physiol.. 28, 2001, S. 577- 590
- ↑ Beilby MJ: Action potentials in charophytes. In: Int. Rev. Cytol.. 257, 2007, S. 43-82. doi:10.1016/S0074-7696(07)57002-6. PMID 17280895
- ↑ Gradmann D, Hoffstadt J: Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations. In: Journal of Membrane Biology. 166, 1998, S. 51-59. PMID 9784585
- ↑ Gradmann D, Mummert H: Plant action potentials. In: Spanswick RM, Lucas WJ, Dainty J Plant Membrane Transport: Current Conceptual Issues, S. 333-344, Amsterdam: Elsevier Biomedical Press 1980, ISBN 0444801928
Quellen
- Stefan Silbernagl, Agamemnon Despopoulos: Taschenatlas der Physiologie, 2003, Thieme Verlagsgruppe, ISBN 3-13-567706-0 (6. Auflage)
Weblinks
- Axonale Weiterleitung eines Aktionspotentials
- Animation der Kanalöffnung und des Ionenaustauschs – Zugriff: 31. Januar 2008
Wikimedia Foundation.