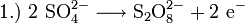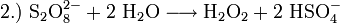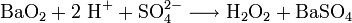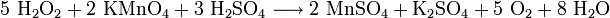- Aktiv-Sauerstoff
-
Strukturformel 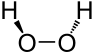
Allgemeines Name Wasserstoffperoxid Andere Namen - μ-1κO,2κO’-Dioxidodiwasserstoff
- Perhydrol
- Wasserstoffsuperoxid
Summenformel H2O2 CAS-Nummer 7722-84-1 (wässrige Lösung) ATC-Code Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 34,02 g·mol−1 Aggregatzustand flüssig
Dichte 1,45 g·cm−3 (20 °C, rein)[1]
1,11 g·cm−3 (20 °C, 30-prozentig)[1]Schmelzpunkt −0,41 °C (rein)[1]
−11 °C (90-prozentig)[1]
−33 °C (35-prozentig)[1]Siedepunkt 150,2 °C (rein)[1]
142 °C (90-prozentig)[1]
108 °C (35-prozentig, unter Zersetzung)[1]Dampfdruck Löslichkeit vollständig mischbar mit Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Brand-
förderndÄtzend (O) (C) wässrige Lösung > 70 %
R- und S-Sätze R: 5-8-20/22-35 S: (1/2)-17-26-28-36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 0,5 ml·m−3 bzw. 0,71 mg·m−3[1]
Thermodynamische Eigenschaften ΔHf0 −188 kJ·mol−1[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Wasserstoffperoxid (H2O2) ist eine blassblaue, in verdünnter Form farblose, weitgehend stabile Flüssigverbindung aus Wasserstoff und Sauerstoff. Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie z. B. Kupfer, Messing, Kaliumiodid reagiert und somit als starkes Bleich- und Desinfektionsmittel fungiert. In hochkonzentrierter Form ist es sowohl als Einzel- als auch als Komponentenraketentreibstoff einsetzbar.
Inhaltsverzeichnis
Geschichte
Wasserstoffperoxid wurde zum ersten Mal 1818 von Louis Jacques Thénard durch Reaktion von Bariumperoxid mit Salpetersäure dargestellt.[4] Das Verfahren wurde zunächst durch den Einsatz von Salzsäure, dann von Schwefelsäure verbessert. Diese eignet sich besonders gut, da das Nebenprodukt Bariumsulfat dabei ausfällt. Thénards Verfahren wurde vom Ende des 19. Jahrhunderts bis in die Mitte des 20. Jahrhunderts benutzt.[5]
Lange Zeit glaubte man, dass reines Wasserstoffperoxid instabil sei, da Versuche, es vom bei der Herstellung anfallenden Wasser zu trennen, scheiterten. Dies war der Tatsache geschuldet, dass Festkörperspuren und Schwermetallionen zu einem katalytischen Abbau oder gar zu einer Explosion führen. Absolut reines Wasserstoffperoxid wurde erstmals 1894 von Richard Wolffenstein per Vakuumdestillation gewonnen.[6]
Physikalische Eigenschaften
 Wasserstoffperoxid als Stäbchenmodell
Wasserstoffperoxid als StäbchenmodellDas H2O2-Molekül ist gewinkelt (Diederwinkel = 111°). Wegen der starken Vernetzung durch Wasserstoffbrücken ist reines Wasserstoffperoxid sehr viskos. Hochkonzentrierte Lösungen von H2O2 neigen, speziell bei Kontakt mit Metalloberflächen bzw. -salzen, zu spontaner Zersetzung.
Herstellung
Früher wurde Wasserstoffperoxid hauptsächlich durch Elektrolyse von Schwefelsäure hergestellt. Dabei bildet sich Peroxodischwefelsäure, die dann wieder zu Schwefelsäure und Wasserstoffperoxid hydrolysiert wird.
Heute wird Wasserstoffperoxid technisch durch das Anthrachinon-Verfahren hergestellt. Dazu wird Anthrahydrochinon mit Luftsauerstoff unter Druck zu Wasserstoffperoxid und Anthrachinon umgesetzt. Anthrachinon kann im nächsten Schritt erneut mit Wasserstoff zum Anthrahydrochinon reduziert werden. Die Bruttogleichung lautet:
Im Labormaßstab wird Wasserstoffperoxid auch bei der Behandlung von Peroxiden mit Säuren hergestellt. Ein historisch wichtiges Reagenz ist Bariumperoxid, das in einer schwefelsauren Lösung zu Wasserstoffperoxid und Bariumsulfat reagiert.
Die molaren Bildungsenthalpien betragen:
- ΔfH0gas: −136,11 kJ/mol
- ΔfH0liq: −188 kJ/mol
- ΔfH0sol: −200 kJ/mol
Chemische Eigenschaften
Wasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen. Dabei wird eine Energie von 98,02 kJ/mol freigesetzt:
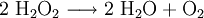
- Disproportionierung zweier Moleküle Wasserstoffperoxid zu Wasser und Sauerstoff.
Diese Zersetzungsreaktion wird unter anderem durch Mn2+- (siehe Nachweis) oder andere Schwermetallionen, I−- und OH−-Ionen katalysiert. Daher werden H2O2-Lösungen im Handel mit Stabilisatoren (unter anderem Phosphorsäure) versetzt. Es ist ein starkes Oxidationsmittel. Unter Verminderung der Oxidationsstufe von −I auf −II entstehen als Reaktionsprodukte nur Wasser und Sauerstoff. Schwer abzutrennende oder störende Nebenprodukte fallen nicht an, was seine Anwendung im Labor vereinfacht.
Abhängig von der Lage beider Redox-Potentiale kann H2O2 auch als Reduktionsmittel wirken, so wird das MnVII (im Kaliumpermanganat) reduziert.
Wasserstoffperoxid ist eine sehr schwache Säure; seine anorganischen Salze und organischen Ester sind die Hydroperoxide und Peroxide.
Nachweis
Qualitativ wird einer neutralen Probelösung eine Lösung von MnSO4 zugesetzt. Durch Oxidation der Mn2+-Ionen entwickelt sich Gas, das mit der Glimmspanprobe auf Sauerstoff geprüft wird. Glüht der Glimmspan auf, ist H2O2 zugegen.
Nachweis als Chromperoxid (CrO(O2)2)
Chromtrioxid CrO3 wird im stark sauren Bereich (pH < 0) durch Wasserstoffperoxid zu intensiv blauem und etherlöslichem Chromperoxid (CrO(O2)2) umgesetzt. Zur Durchführung wird Kaliumdichromat im Reagenzglas mit verdünnter H2SO4 angesäuert und mit 1 cm Ether überschichtet. Die wasserstoffperoxidverdächtigte Probe wird zugesetzt. Färbt sich die Ether-Phase beim leichten Schütteln bläulich, ist der Nachweis erbracht. Wegen der Verwendung giftiger und kanzerogener Chrom(VI)-Verbindungen ist dieser Test heute nicht mehr üblich.Nachweis als Peroxotitanyl(IV)-Ion ([Ti(O2)OH+])
Der Nachweis als „Titangelb“ (nicht zu verwechseln mit dem organischen Reagenz gleichen Namens) ist sehr empfindlich. Werden farblose Titan(IV)-Ionen mit Spuren von Wasserstoffperoxid in Verbindung gebracht, weist das intensiv orangegelb gefärbte Peroxotitanyl-Ion die Anwesenheit nach. Mit Wasserstoffperoxid lassen sich Substanzen wiederum auf Titan(IV) prüfen.Nachweis mit Kaliumpermanganat
Quantitativ kann die Konzentration von Wasserstoffperoxid in wässrigen Lösungen mit n/10 Kaliumpermanganat-Lösung oximetrisch in schwefelsaurer Lösung titriert werden. Der Umschlag erfolgt bis zur schwach rosa Färbung, die ca. 1 min. anhaltend sein sollte.Physiologie
Wasserstoffperoxid wirkt stark ätzend, besonders als Dampf. Falls man Wasserstoffperoxid auf die Haut bekommt, sollte man die Stelle mit Wasser gut spülen (Verdünnung), oder zumindest sofort von der Haut entfernen. Dringt es in die Haut ein, so zersetzt es sich dort rasch und die entstehenden Sauerstoffbläschen lassen die Haut weiß erscheinen.
Allgemein wirkt Wasserstoffperoxid zytotoxisch und durch seine starke Toxizität gegenüber vielen prokaryontischen Kleinstlebewesen desinfizierend.
Wasserstoffperoxid entsteht bei zahlreichen biochemischen Prozessen. Im biologischen Kreislauf entsteht es durch die oxidative Metabolisierung von Zucker. Der Organismus schützt sich gegen seine toxische Wirkung mithilfe von Enzymen – Katalasen, Peroxidasen –, die es wieder zum ungiftigen O2 und H2O zersetzen.
Die weibliche Eizelle produziert nach der Befruchtung durch ein Spermium kurzzeitig Wasserstoffperoxid in geringer Konzentration, um andere Spermien abzutöten.
Zudem stellt Wasserstoffperoxid ein Signalmolekül für die Induktion der pflanzlichen Abwehr von Pathogenen dar (Aspekt der Zytotoxizität).
Verwendung
Hochkonzentrierte Lösungen von Wasserstoffperoxid können sich spontan unter Explosion zersetzen, daher sind im Handel maximal 35-prozentige Lösungen in Wasser frei erhältlich. Für den Industriebedarf gibt es Konzentrationen bis zu 50 % H2O2 in Wasser.
Bleichmittel
Wasserstoffperoxid ist ein Bleichmittel. Weltweit die häufigste Anwendung ist die Bleiche von Zellstoff. Zellstoff wird aus Holz gewonnen und das enthaltene Lignin gibt dem Zellstoff einen Gilbton, der bei der Hauptverwendung von Zellstoff für Papier und Papiererzeugnisse als störend empfunden wird.
Im Handwerk werden Hölzer bei der Restaurierung oder der Renovierung mit Wasserstoffperoxid gebleicht und dadurch aufgehellt.
Es kommt zum Blondieren von Haaren zum Einsatz und beim Bleichen von Zähnen. Häufig wird es als an Carbamid gebundenes Peroxid eingesetzt.
Wasserstoffperoxid und wasserstoffperoxidhaltige Bleichmittel, wie etwa ein Peroxyessigsäure-Wasserstoffperoxid-Gemisch, werden in der Werbesprache auch mit dem Kunstwort Aktiv-Sauerstoff bezeichnet. Außer dem Wasserstoffperoxid kommen für Bleichzwecke auch andere Peroxide in Frage, die beim Zutritt von Wasser zerfallen und den aktiven (atomaren) Sauerstoff abgegeben.
Graufärbung von Haaren im Alter
Deutsche und britische Forscher geben in einer Studie im März 2009 bekannt, dass die Graufärbung von Haaren im Alter Folge eines geringeren Abbaus von Wasserstoffperoxid in den Haaren ist. [7]
Desinfektion und Sterilisation
Eine dreiprozentige Lösung Wasserstoffperoxid wird zur Desinfektion, auch im Haushaltsbereich, eingesetzt. Einsatzbeispiele sind Mund- und Rachenraum (zum Gurgeln auf 0,3 Prozent verdünnen), die Zahnmedizin, die Desinfektion von Kontaktlinsen in Reinigern, die Entkeimung von Packstoffen oder die Desinfektion der Hände in Krankheitsfällen. Demgemäß kommt es in Gesichtscremes zum Einsatz: zur Reinigung der Poren und der Bekämpfung von Pickeln und Hautverunreinigungen. Auch bei der Reinigung von industriellen Abwässern und in der Schwimmbadetechnik erfolgt damit die Desinfektion des Wassers.
Die 35-prozentige Lösung von Wasserstoffperoxid wird in der Lebensmittelindustrie in aseptischen Abfüllanlagen zur Sterilisation von PET-Flaschen, Kunststoffbehältern und den typischen mehrschichtigen Kartonverpackungen verwendet. Zahlreiche Lebensmittel (Getränke, Milch, Milchprodukte, Soßen, Suppen) werden heute zur besseren Haltbarkeit und Produktqualität in Kartons, Becher, Flaschen und Folien aseptisch abgepackt. Dabei wird das Verpackungsmaterial mit 35-prozentigem Wasserstoffperoxid desinfiziert, bevor das jeweilige Lebensmittel eingefüllt wird.
Ein weiteres Anwendungsgebiet ist der Einsatz von gasförmigem H2O2 zur Reinraumdekontamination. Dazu wird eine üblicherweise 35-prozentige Lösung in einem speziellen Apparat verdampft und in den zu dekontaminierenden Bereich (Raum, Kammer, etc.) geblasen.
Die hohe bakterizide Wirkung von H2O2, die Umweltverträglichkeit und die gute technische Realisierbarkeit sind die Gründe für die weite Verbreitung dieses Verfahrens.
Sauerstoffzuführung
Wasserstoffperoxid kann in Aquarien zum Zuführen von Sauerstoff benutzt werden. Die Sauerstofferzeugung geschieht in einem Oxidator. Dazu wird in einem Gefäß im Aquarium Wasserstoffperoxid mit Hilfe eines Katalysators in Wasser und Sauerstoffradikale gespalten.
Gegen Schimmelbefall
Bei der Innenrenovierung kann Schimmelpilzbefall mit Wasserstoffperoxid bekämpft werden. Dabei wirkt es desinfizierend sowohl gegen die biologisch aktiven Pilzzellen (Fungizid) als auch gegen die Sporen der Schimmelpilze (Sporizid).
Durch die bleichende Wirkung entfernt es auch „optisch“ die Rückstände des Schimmelbelags von porösen Untergründen. Wasserstoffperoxid hat gegenüber Alkohol oder Chlorbleichlauge einige Vorteile, da es besser bleicht und sporizid wirkt und keine Nebenprodukte hinterlässt.
Medizin
In der Zahnmedizin wird H2O2 zur lokalen Desinfektion des Zahngewebes und zur Blutstillung bei kleineren Eingriffen verwendet.
Bei der Präparation von Knochen dient Wasserstoffperoxid zum Bleichen und Desinfizieren.
Seit geraumer Zeit wird ein Verfahren zum Sterilisieren von bestimmten Medizinprodukten und chirurgischen Instrumenten angewandt, in dem H2O2 als Prozesschemikalie Verwendung findet (H2O2-Plasmaverfahren). Besonders bei thermolabilen Produkten bringt es Vorteile gegenüber der Dampfsterilisation, da bei Raumtemperatur Wasserstoffperoxid bis zu einem Druck von 11 mbar verdampft wird.[8]
Landwirtschaft
In der Landwirtschaft wird Wasserstoffperoxid zur Desinfektion in Gewächshäusern und zur Sauerstoffanreicherung in Nährlösungen von Hydrokulturen benutzt.
Biologie
Für die Bestimmung von Bakterienkulturen wird der Katalase-Test mit 3-prozentiger Wasserstoffperoxidlösung durchgeführt. Die meisten aeroben und fakultativ anaeroben Bakterien wie auch Pilze haben das Enzym Katalase, welches imstande ist, das für die Zellen giftige H2O2 zu spalten.
Experimentell wird Wasserstoffperoxid in der Biologie zur Herbeiführung des programmierten Zelltodes von isolierten eukaryontischen Zellen genutzt.
Forensik
Wasserstoffperoxid wird in der Forensik zum Nachweis von Blut verwendet. Louis Jacques Thénard entdeckte 1818, dass die Peroxidase im Hämoglobin Wasserstoffperoxid zersetzt. Christian Friedrich Schönbein entwickelte daraus 1863 einen Test auf Blut. Heute wird jedoch der empfindlichere Kastle-Meyer-Test zum Nachweis von Blut verwendet.
Ätzmittel
In der Mikroelektronik benutzt man das Gemisch von Schwefelsäure und Wasserstoffperoxid – „Piranha“ genannt – zur Reinigung der Oberfläche von Wafern und zur Erzeugung einer dünnen, etwa 3–4 nm dicken hydrophilen Oxidschicht auf den Wafern. Heutzutage ist die Bezeichnung „SPM“ (Sulfuric Peroxide Mixture) geläufiger. Die Hauptanwendung ist das Entfernen von Fotolacken.
Bei der Herstellung von gedruckten Leiterplatten (Platinen) werden Kupferchlorid-Ätzbäder zum Entfernen des Kupfers verwendet:
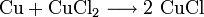 .
.- Elementares Kupfer reagiert mit Kupfer(II)-chlorid zu Kupfer(I)-chlorid. Es handelt sich hierbei um eine Komproportionierung.
Zur Regeneration der Kupferchlorid-Ätzbäder wird Wasserstoffperoxid zusammen mit Salzsäure eingesetzt:
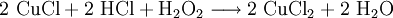 .
.- Durch Reaktion des Kupfer(I)-chlorid mit Wasserstoffperoxid und Salzsäure wird das Kupfer(II)-chlorid regeneriert. Das Kupferatom wird dabei oxidiert.
Dabei werden die Wasserstoffperoxid- und Salzsäurezugabe über das Redoxpotential gesteuert.
Raketen-/Torpedotriebwerke
Als Sauerstofflieferant wird H2O2 durch Zersetzung (vorzugsweise über Braunstein) in U-Booten eingesetzt. In konzentrierter Form kam es bei Raketenantrieben bei Max Valier und der Messerschmitt Me 163 zum Einsatz, außerdem bei U-Boot-Antrieben (Walter-U-Boot). Mit Hilfe von Kaliumpermanganat zersetztes Wasserstoffperoxid wurde als Treibgas für die Treibstoffpumpen (500 PS Leistung) der A4 verwendet. In britischen Raketen (Black Arrow) wurde unzersetztes Wasserstoffperoxid als bei Normaltemperatur flüssiger Sauerstoffträger benutzt und mit Kerosin verbrannt.
Eine der Thesen zum Untergang des russischen Atom-U-Boots Kursk im Jahre 2000 besagte, dass Wasserstoffperoxid aus einem Tank eines Torpedos drang und nach Reaktion mit Kupferteilen den Torpedo sprengte.
Ein derartiges Treibstoffgemisch (85–98 % Wasserstoffperoxid) für Raketen und Torpedos wird im Englischen auch als HTP (High Test Peroxide) bezeichnet.
Zersetzungsgefahr
Wasserstoffperoxid neigt zu unkontrollierter Zersetzung. So starben am 16. Juli 1934 Dr. Kurt Wahmke und zwei Techniker in Kummersdorf bei der Explosion eines mit Wasserstoffperoxid betriebenen Triebwerkes. Aufgrund der Gefährlichkeit in Einsatz und Handhabung (Ätzwirkung, unkontrollierte Zersetzung, Explosion bei Verunreinigungen in Tank und Leitungssystem) ist der Gebrauch heute auf Kleinraketentriebwerke (Rekordversuche, Steuertriebwerke) beschränkt.
Brandgefahr kann in geeigneter Verbindung mit Eisenspänen und Putzlappen entstehen, die UVV schreibt deshalb Vorsichtsmaßnahmen bei der Prozesswasseraufbereitung in metallverarbeitenden Betrieben vor.
Sprengstoffherstellung
Durch die Peroxidgruppe ist die Verbindung energiereich und zerfällt unter Sauerstofffreigabe. Wasserstoffperoxid reagiert in Anwesenheit eines geeigneten Katalysators mit Aceton zu Acetonperoxid, das ein Triaceton-Triperoxid ist und als Sprengstoff mit TATP bezeichnet wird. Unter Nutzung von Wasserstoffperoxid wird auch der Sprengstoff Hexamethylentriperoxiddiamin (HMTD) hergestellt.
→ Hauptartikel: Acetonperoxid
Literatur
- Werner R. Thiel: Neue Wege zu Wasserstoffperoxid: Alternativen zu etablierten Prozessen?. Angewandte Chemie 111(21), S. 3349–3351, 1999.
- Heribert Offermanns, Gunther Dittrich, Norbert Steiner: Wasserstoffperoxid in Umweltschutz und Synthese. Chemie in unserer Zeit 34(3), S. 150–159 (2000), ISSN 0009-2851.
Weblinks
- Zersetzung von Wasserstoffperoxid (Katalase)
- Nachweis als Chromperoxid
- Wasserstoffperoxid in Zahnbleichmitteln Kurzfassung eines Berichts des Wissenschaftlichen Ausschusses „Konsumgüter“ der Europäischen Kommission
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Wasserstoffperoxid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 16.11.2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7722-84-1 im European chemical Substances Information System ESIS
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Louis Jacques Thénard, Annales de chimie et de physique, 1818, 8, S. 308.
- ↑ C. W. Jones, J. H. Clark. Applications of Hydrogen Peroxide and Deriatives. Royal Society of Chemistry, 1999.
- ↑ Richard Wolffenstein: Concentration und Destillation von Wasserstoffsuperoxyd. In: Berichte der deutschen chemischen Gesellschaft, 1894, 27, 3, S. 3307–3312, doi:10.1002/cber.189402703127
- ↑ Sueddeutsche:Forscher entschlüsseln Geheimnis der grauen Haare
- ↑ http://dip.bundestag.de/btd/13/010/1301049.asc Deutscher Bundestag – Drucksache 13/1049 vom 4.4.1995
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.