- Formale Ladung
-
Mit einer Formalladung werden Atome in einer chemischen Formel versehen, um die Differenz zwischen der positiven Kernladung und den diesem Atom zugeteilten Elektronen anzugeben, basierend auf der formalen Grundlage der gleichmäßigen Aufteilung der Bindungselektronen.
Inhaltsverzeichnis
Wesen der Formalladung
Ein nach außen elektrisch neutrales Atom besitzt genauso viele elektrisch negative Elektronen in seiner Hülle wie es positive Protonen in seinem Atomkern hat. In einer kovalenten Bindung zwischen Atomen, die ein Molekül aufbauen, wird deren Zusammenhalt durch jeweils zwei Elektronen mit Ladungsschwerpunkt zwischen diesen Atomen bewirkt (wobei die genaue Geometrie der Ladungsverteilung von der Art der Bindung abhängt). Um nun den formalen Ladungszustand der Atome in einem Molekül zu bestimmen, werden alle Bindungselektronen den jeweils involvierten Atomen gleichmäßig zugeteilt, sodass jedes eine bestimmte Anzahl von Elektronen - negativen Ladungsträgern - erhält. Vergleicht man nun diese für ein bestimmtes Atom - unter Beachtung seiner freien Elektronenpaare und nicht-Valenzelektronen - mit seiner positiven Kernladung, so entspricht die Differenz der Formalladung des betrachteten Atoms.
Die Summe aller formalen Ladungen gleicht der Gesamtladung des Molekül(ion)s.
Beispiele:
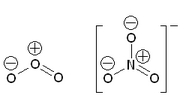
- Das Ozon-Molekül (O3) ist elektrisch neutral und die Summenladung damit null.
- Das Nitrat-Anion (NO3-) dagegen ist einfach negativ geladen, die Summe der Formalladungen beträgt demzufolge -1.
- Das Calcium-Kation (Ca2+) wiederum ist zweifach positiv geladen, die Formalladung entspricht somit der echten Ladung und beträgt +2.
Verwendung
In den meisten Darstellungen kovalenter Bindungen gleichen die Anzahl zugeteilter Elektronen und Kernprotonen einander aus, d.h., die formale Ladung der beteiligten Atome ist null. Zur Deutung von Reaktivitäten chemischer Verbindungen können Bindungen jedoch unterschiedlich aufgeteilt werden, sodass in bestimmten mesomeren Grenzformeln Formalladungen auftauchen. Bisweilen werden sie auch benötigt, um Lewis-Strukturen mancher Moleküle vereinbar mit energetisch wahrscheinlichen Elektronenverteilungen (Oktettregel) darstellen zu können.
Die Anzahl der formalen Ladungen in der Darstellung eines Moleküls hat einen gewichtigen Einfluss auf den Anteil der mesomeren Grenzstruktur an der tatsächlichen Ladungsverteilung. Allgemein gilt, dass unter diesem Gesichtspunkt möglichst wenigen Atomen eine Formalladung zugeteilt werden und diese Ladungen (welche immer ganze Zahlen annehmen) möglichst klein sein sollen. Außerdem soll die Verteilung der formalen Ladungen die Elektronegativitäten der vorhandenen Elemente berücksichtigen. Grenzformeln mit benachbarten Formalladungen gleichen Vorzeichens werden dabei meist nicht beachtet.
Zur konsequenten Unterscheidung formaler und tatsächlicher Ladungen von Ionen sollten erstere mit den wie in der Abbildung angegebenen Symbolen repräsentiert werden. In der Literatur wird dies jedoch oft vernachlässigt und außerdem auf die zusätzliche Angabe der Gesamtladung verzichtet.
Siehe auch
Literatur
C.E. Mortimer, U. Müller: Chemie, 8. Aufl., 114ff., Thieme, Stuttgart, 2003
Wikimedia Foundation.