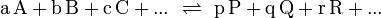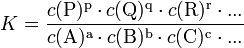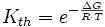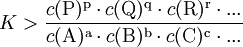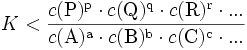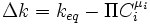- Gleichgewichtskonstanten
-
Die Gleichgewichtskonstante K (engl. equilibrium constant), gibt ein Verhältnis von Mengen der bei einer chemischen Reaktion beteiligten Stoffe wieder, für das ein Nettofluss durch die chemische Reaktion energetisch unmöglich wird. Liegen die Edukte und Produkte der Reaktion in dem durch die Gleichgewichtskonstante gegebenen Verhältnis vor, so befindet sich die Reaktion im chemischen Gleichgewicht. Dann findet kein Nettofluss durch die Reaktion statt. Der Fluss durch die Hinreaktion ist gleich dem Fluss durch die Rückreaktion.
Die Gleichgewichtskonstante einer Reaktion
ist thermodynamisch durch das Verhältnis (Massenwirkungsgesetz) der Konzentrationen der Edukte
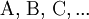 und Produkte
und Produkte 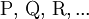
definiert (hierfür sind jeweils die Gleichgewichtskonzentrationen zu nehmen), für die die Änderung der Gibbs-Energie der Reaktion null ist. Hierbei ist c(A) (früher auch [A] geschrieben) die Konzentration des Stoffes A (Stoffmenge von A pro Volumen). Streng genommen ist mit Aktivitäten statt Konzentrationen zu rechnen, bzw. sind die Konzentrationen noch mit Aktivitätskoeffizienten zu multiplizieren.
Ist die Änderung der Gibbs-Energie ΔG einer Reaktion bekannt, lässt sich daraus die Gleichgewichtskonstante berechnen:
wobei R die Universelle Gaskonstante, T die Temperatur und e die eulersche Zahl ist.
Die Gleichgewichtskonstante macht eine Aussage über die mögliche Richtung und die Energetik einer Reaktion. Sie gibt keinerlei Information über die Geschwindigkeit der Reaktion.
Gilt
so kann die Nettoreaktion nur in folgender Richtung stattfinden
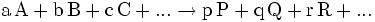 .
.
Gilt
so kann die Nettoreaktion nur in folgender Richtung stattfinden
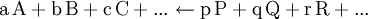 .
.
Für
gibt es keinen Nettofluss durch die Reaktion (Der Fluss durch die Hin- bzw. Rückreaktion sind dann gleich groß. Sie können, aber müssen nicht Null sein).
Deswegen definiert man:
als alternative Kraft. Solange
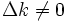 , findet eine Reaktion statt. Ist die Kraft allerdings Null, so befindet sich das System im Gleichgewicht. Die Gleichgewichtskonstante ist eine Funktion der Temperatur. Bei der Reaktion nicht direkt beteiligte Stoffe können die Gleichgewichtskonstante einer Reaktion verändern, z. B. sind Gleichgewichtskonstanten in wässrigen Medien oft stark vom pH-Wert abhängig (siehe Nernstsche Gleichung).
, findet eine Reaktion statt. Ist die Kraft allerdings Null, so befindet sich das System im Gleichgewicht. Die Gleichgewichtskonstante ist eine Funktion der Temperatur. Bei der Reaktion nicht direkt beteiligte Stoffe können die Gleichgewichtskonstante einer Reaktion verändern, z. B. sind Gleichgewichtskonstanten in wässrigen Medien oft stark vom pH-Wert abhängig (siehe Nernstsche Gleichung).Siehe auch
Weblinks
Wikimedia Foundation.